高二化学上学期12月月考测试题
高二化学试题
命题人:李新朵
考生须知:
1.全卷分试卷I和试卷Ⅱ,全卷共7页,有四大题,32小题,满分为100分。考试时间90分钟。
2.试卷I答案必须做在机读卡上,试卷Ⅱ就答在试题卷中相应位置上。
3.请用钢笔或蓝、黑色圆珠笔将姓名、准考证号分别填写在机读卡上、试卷Ⅱ的相应位置上。
4.解答本卷时可能用到的相对原子质量: H-1,C—12,N-14,O-16,Na-23, Mg-24,Al-27,Cl-35.5, Ca-40, Ba-137
试卷Ⅰ(共50分)
一、选择题(本题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意)
1.下列气体中不能用排空气法收集的是
A.CO2 B.NO C.NO2 D.NH3
2.在一定条件下在密闭容器中进行的反应:P(g)+Q(g)![]() R(g)+S(g)
。下列说法中可以充分说明这一反应已经达到化学平衡状态的是
R(g)+S(g)
。下列说法中可以充分说明这一反应已经达到化学平衡状态的是
A.P、Q、R、S的浓度相等
B. P、Q、R、S在密闭容器中共存
C.用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等
D.正、逆反应都在进行并且P、Q、R、S的浓度不再变化
3.下列各反应的化学反应方程式或离子反应方程式中,属于水解反应的是
A.CO32-+H2O![]() HCO3-+OH- B.HCO3-+OH-
HCO3-+OH- B.HCO3-+OH-![]() CO32-+H2O
CO32-+H2O
C.CO2+H2O![]() H2CO3 D.H2O+H2O
H2CO3 D.H2O+H2O![]() H3O++OH-
H3O++OH-
4.相同物质的量的镁和铝,分别跟足量的盐酸反应,生成氢气的物质的量之比为
A.1:1 B.1:2 C.2:3 D.3:4
5.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为
A.3:1 B.1:3 C.1:2 D.2:1
6. 某元素R最外层有5个电子,它的含氧酸钾盐的化学式不可能是
A.KRO3 B.K3RO4 C.KRO2 D.K2RO4
7.在标准状况下,在三个干燥烧瓶内,分别装有:甲干燥纯净的NH3,乙一半空气一半HCl,丙为NO2与O2体积比为4:1的混合气体,然后分别做喷泉实验,则三个烧瓶中所得溶液的物质的量浓度之比为
A. 2:1:2 B.5:5:4 C.1:1:1 D.无法确定
8.某溶液能与铝片作用产生H2,则该溶液中可以大量共存的离子组是
A.Na+、NO3-、K+、Fe2+ B.Fe2+、Na+、Cl-、K+
C.K+、I-、NO3-、H+ D.NH4+、NO3-、Na+、HCO3-
9.在BaCl2溶液中通入SO2气体,未见沉淀,若先通入另一种气体后再通入SO2 气体,则可以看到有沉淀生成,这种气体不可能是
A. HCl B.Cl2 C.NH3 D.NO2 1
10.一定条件下,在2L密闭容器中进行反应3H2+N2![]() 2NH3,经过一段时间后,NH3的物质的量为0.8mol,在这段时间内用N2表示的反应速率为0.01mol·L-1·S-1。则这段时间为
2NH3,经过一段时间后,NH3的物质的量为0.8mol,在这段时间内用N2表示的反应速率为0.01mol·L-1·S-1。则这段时间为
A.10s B.30s C.20s D.40s
11.在一定条件下,反应2SO2+O2![]() 2SO3达到化学平衡后,再向容器中加入含氧的同位素18 8O的氧气,经过一段时间后18 8O存在于
2SO3达到化学平衡后,再向容器中加入含氧的同位素18 8O的氧气,经过一段时间后18 8O存在于
A.O2 B. SO2 C.SO3 D.O2、SO2和SO3
12.在一定温度下,密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
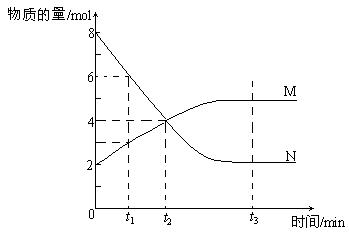
A.反应的化学方程式为:2 M![]() N
N
B.t2时,正逆反应速率相等,达到了化学平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
13.下列有关pH变化的判断中,正确的是
A. 新制氯水经光照一段时间后,pH减小
B. 随温度的升高,纯水的pH增大
C. 随温度的升高,碳酸钠溶液的pH减小
D.氢氧化钠溶液久置于空气中,pH增大
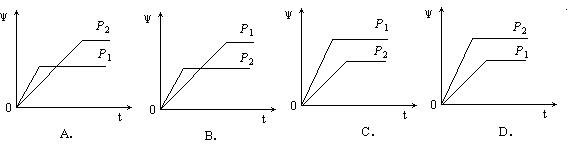
14.在一定温度不同压强(P1<P2)下,可逆反应 2X(g) ![]() 2Y(g) + Z(g) 中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g) 中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
15.合成氨时,既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合物中分离出NH3 ⑥充入N2或H2
⑦加催化剂 ⑧减小N2或H2的量
A. ①③④⑤⑦ B. ②⑤⑥ C.②⑥ D. ②③⑥⑦
16.对于KHSO4在水溶液中或熔化状态下都能电离出的离子是
A.SO42- B.K+ C.H+ D.HSO4-
17.将0.l mol·![]() 醋酸溶液加水稀释,下列说法正确的是
醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
18.常温时,以下4种溶液pH最小的是
A.0.01mol ·L-1醋酸溶液
B.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积混合液
C.0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
19.关于小苏打溶液的表述正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+(H2CO3)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有NaHCO3=Na++HCO32-,HCO3-=H++CO32-,H2O=H++OH-
20.313K时,水的Kw=3.8×10-14,若在313K时,c(H+)=1×10-7 mol/L的溶液
A.呈酸性 B.呈碱性 C.呈中性 D.无法判断
21.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7。下表中判断合理的是
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
A.①③ B.②③ C.①④ D. ②④
22.一定体积的pH为2的盐酸溶液和pH为11的NaOH溶液混合后恰好完全反应,二者的体积比为
A.1:1 B.10:1 C.1:10 D.1:100
23.下列物质中,加入10mL盐酸溶液时,其pH不会变的是
A.20mL NH4Cl溶液 B.20mL同一浓度的盐酸溶液
C.10mL 水 D.10mL稀NaOH溶液
24.下列反应达到化学平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2(g)![]() N2O4(g)(正反应为放热反应)
N2O4(g)(正反应为放热反应)
B.3O2(g)![]() 2O3(g)(正反应为吸热反应)
2O3(g)(正反应为吸热反应)
C.H2(g)+I2(g)![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D.NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
25.将含有杂质的4.0g 氢氧化钠固体配成1000mL溶液,取20.00mL装入锥形瓶中,用0.1000mol/L盐酸滴定(甲基橙作指示剂),消耗盐酸19.00mL,则该氢氧化钠中含的杂质不可能是
A.硫酸钠 B.碳酸钠 C.氢氧化钙 D.碳酸氢钠
![]()
 试卷Ⅱ(共50分)
试卷Ⅱ(共50分)
二、填空题(本题包括2小题,共12 分)
26.(6分)25℃时,若体积为Va、pH=a的某一元强酸溶液与体积Vb、pH=b的某一元强碱溶液混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”)_________,其理由是__________________
______________________________________________________________________;
(2)a值可否等于5(填“可”或“否”)________,其理由是___________________
_______________________________________________________________________;
______________________________________________________________________
(3)a的取值范围是_______________________________________。
27.(6分)有四种含铝元素的化合物A、B、C、D,并且能发生如下反应:
①A+NaOH![]() D+H2O
② B
D+H2O
② B![]() A+H2O
A+H2O
③C+NaOH(适量)![]() B+NaCl ④向D溶液中滴入盐酸能生成沉淀,当盐酸过量时沉淀又溶解。
B+NaCl ④向D溶液中滴入盐酸能生成沉淀,当盐酸过量时沉淀又溶解。
则A、B、C、D的化学式分别为
A_______________、B_____________、C_____________、D_______________;
反应④有关的离子反应方程式为
____________________________________________________________________
 三、实验题(共3小题,共28分)
三、实验题(共3小题,共28分)
28.(6分)填空
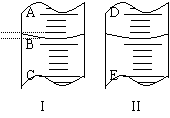
⑴图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是___________mL。
⑵图Ⅱ表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________,
A.是a mL B.是(50-a)mL C.一定大于a mL D.一定大于(50-a)mL
⑶若图Ⅰ表示50mL滴定管中液面位置,A与C间刻度相差1mL,如刻度A为4,则液面读数为______________mL。
29.(12分)喷泉是一种常见的自然现象,其产生原因是存在压强差。

![]()
![]()
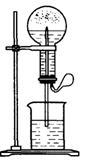
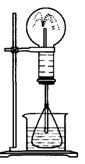
图1 图2
(1)图1为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是________
A. HCl和H2O B. O2和H2O
C. NH3和H2O D. CO2和NaOH
(2)某学生积极思考产生喷泉的其他办法,并设计了如图2所示的装置。
①在图2的锥形瓶内,分别加入足量下列物质,反应后可能产生喷泉的是_______
A. Cu与稀盐酸 B. NaHCO3与NaOH
C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
②在图2的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉,水槽中加入的物质可以是_______
A. 浓硫酸 B. 食盐 C. 硝酸钾 D. 硫酸铜
③比较图1和图2两套装置,从产生喷泉的原理来分析,图1是_______上部烧瓶内气体压强,图2是_______下部锥形瓶内气体压强(均填“增大”或“减小”)
(3)城市中常见的人造喷泉及火山喷发的原理与上述__________(填“图1”或“图2”)装置的原理相似。
30.(10分)以下是测定盐酸物质的量浓度的实验:
①首先配制0.1000mol·L-1 NaOH溶液1L;
②将待测盐酸稀释10倍; ③取稀释后的盐酸10.00mL放入锥形瓶中、滴入指示剂;
④用NaOH标准溶液进行滴定;
⑤滴定重复进行3次,求出滴定中所用标准溶液体积的平均值,根据以上操作,回答下列问题:
⑴从下列选项中选出①、③操作中需要的仪器,用序号回答:
a.表面皿 b.容量瓶 c.碱式滴定管 d.酸式滴定管 e.烧杯 f.烧瓶 g.胶头滴管
①_________、③__________;
⑵设⑤中的平均值为7.50mL,则未稀释时盐酸的物质的量浓度为___________mol/L;
⑶如果碱式滴定管用水洗净后,未用标准溶液润洗,则HCl的物质的量浓度________,如果锥形瓶用水洗后,又用待测液润洗,则HCl的物质的量浓度_________(填“偏高”、“偏低”或“无影响”);
⑷该实验选用的指示剂最适合的是_______;
A.甲基橙(3.1~4.4) B.酚酞(8~10) C.石蕊(5~8) D.淀粉液
⑸滴加指示剂最适合的体积是_______。
A.1~2mL B.2~3mL C.2~3滴 D.越多越好或越少越好
四、计算题(共2小题,共10分)
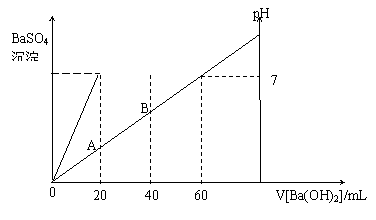 31.(6分)现有硫酸和盐酸的混合溶液20mL,在该溶液中滴入0.05mol/L的Ba(OH)2溶液时,生成BaSO4的质量和溶液的pH得到如图所示的结果,求:
31.(6分)现有硫酸和盐酸的混合溶液20mL,在该溶液中滴入0.05mol/L的Ba(OH)2溶液时,生成BaSO4的质量和溶液的pH得到如图所示的结果,求:
⑴最初混合液中硫酸的物质的量浓度_____________和盐酸的物质的量浓度____________
⑵在A点溶液的pH=_______________。
32.(4分)向100mL 0.6mol/L的AlCl3溶液中加入0.4mol/L的NaOH溶液后,得到3.9g沉淀,此时消耗NaOH溶液的体积是_______________mL或___________________mL。
高二化学试题答案
一、选择题
| 题 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答 | B | D | A | C | C | D | B | B | A | C | D | D | A | B | C | B | D | A |
| 题 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答 | A | B | D | C | B | B | C |
|
二、填空题26.(1)否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
![]()
(2)否,若a=5,c(H+)a=10-5mol·L-1,则b=10,c(OH-)b = 10-4mol·L‑1 ,![]() ,不符合题意,故a≠5
,不符合题意,故a≠5
(3)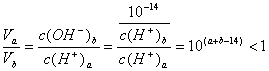
所以(a+b-14)<0,而a=0.5b
即3a<14,a<![]() 又pH=b=2a>7,a>
又pH=b=2a>7,a>![]()
所以![]() <a<
<a<![]()
27.A- Al2O3 B- Al(OH)3 C- AlCl3 D- NaAlO2
AlO2- + H+ +H2O=Al(OH)3↓ Al(OH)3+3H+=Al3+ +3H2O
三、实验题
28.⑴3.2 ⑵D ⑶4.40
29.(1)B (2)①D ②A ③减小;增大 (3)图2
30.⑴①beg ③dg ⑵0.7500mol·L-1 ⑶偏大 偏大 ⑷B ⑸C
四、计算题
31.⑴0.05mol/L 和0.2mol/L ⑵pH=1
32. 375mL或475mL