高二化学上学期月考试卷
可能用到的相对原子质量:Cu-64 N-14 O-16 H-1 Fe-56 S-32
一、选择题(本题包括8小题,每小题2分,共16分,每小题只有一个正确答案)
1. 下列叙述能说明R元素是氮族元素的是B) ( ( )
A.R元素的最高价是+5价
B.R元素有气态氢化物RH3
C.R的氧化物可形成化学式为HRO3的含氧酸
D.其含氧酸是一元强酸
2.判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂是( )
B A.浓盐酸 B.硝酸 C.王水 D.稀硫酸
3.已知反应:①3Cl2+8NH3 =N2+6NH4Cl, ②3H2+N2=2NH3 。试判断下列物质还原性由强到弱的顺序是C ( )
A. NH4Cl、 NH3、 H2 B. NH3、 NH4Cl、H2
C. H2 、NH3 、NH4Cl D. H2、NH4Cl、 NH3
4.下列事实中,能说明氮的非金属性比磷强的是:①硝酸的酸性比磷酸强 ②NH3比PH3稳定性强 ③硝酸显强氧化性 ④在常温下氮单质为气体,磷单质为固体 ⑤NH3易溶于水而PH3难溶于水 C ( )
A.只有①②④ B.只有②③⑤ C.只有①② D.全部
5.在标准状况下,将250 mL烧瓶充满氨气后倒置于水槽中,假设进入烧瓶内的溶液不向外扩散,则烧瓶中氨水的物质的量浓度最近于 ( )
A.1.0 mol/L B.0.045 mol/L C.0.029 mol/L D.0.118 mol/L
6.密闭容器中进行反应:A(g) +2B(g)![]() 3C(g) +D(s),能说明该反应已达到化学平衡的是D ( )
3C(g) +D(s),能说明该反应已达到化学平衡的是D ( )
A.A、B、C、D物质的量之比为1∶2∶3∶1
B.压强不随时间变化而变化
C.υ(A) ∶υ(B) ∶ υ(C) =1∶2∶3
D.A的体积分数不随时间变化而变化
7.某温度下,反应H2(g)+I2(g) ![]() 2HI(g) △H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是(C
)( )
2HI(g) △H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是(C
)( )
A.体积不变,升温正反应速率减小
B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氦气后,正反应速率将增大
8.决定化学反应速率的根本因素是 ( )
A.温度和压强 B.反应物的浓度
C.催化剂的加入 D.参加反应的各物质的性质
二、选择题(本题包括10小题,每小题只有1~2正确答案,每题3分,共30分)
9.下列说法正确的是 ( )
A.活化分子的每一次碰撞都能够发生化学反应
B.能够发生有效碰撞的分子叫做活化分子
C.反应物用量增加后,有效碰撞次数增多,反应速率增大
D.加入催化剂对化学反应速率无影响
10.某集气瓶内装的混合气体呈红棕色,加入足量水,盖上玻璃片振荡,得棕色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色。该混合气体可能是 ( )
A N2 NO2 Br2 B NO2 NO N2
C NO2 O2 NO D N2 O2 Br2
11.在2L的密闭容器中,发生3A(g)+B(g) ![]() 2C(g)的反应,若最初加入A和B都是4mol,10s后,测得v(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是 ( )
2C(g)的反应,若最初加入A和B都是4mol,10s后,测得v(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是 ( )
A.1.6mol B.2.8mol C.3.2mol D.3.6mol
12.下列分子中,具有极性键的非极性分子是 ( )
A.CO2 B.SO2 C.NH3 D.H2O
13.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到1.12L(标准状况下)气体,则所消耗硝酸的物质的量是 ( B ) ( )
A、0.12mol B、0.11mol C、0.09mol D、0.08mol
14.在一定温度不同压强(p1<p2)下,可逆反应2X(g)![]() 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
( )B
)与反应时间(t)的关系有以下图示,正确的是
( )B
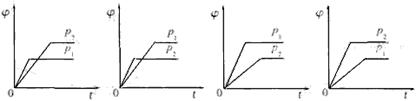
A B C D
![]() 15.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是
A( )B
15.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是
A( )B
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
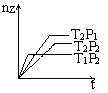 16.反应: 2X(g)+Y(g)
16.反应: 2X(g)+Y(g) ![]() 2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n(Z))与反应时间(t)的关系如图所示。下列判断正确的是
( )
2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n(Z))与反应时间(t)的关系如图所示。下列判断正确的是
( )
A、T1<T2 P1<P2 正反应吸热 B、T1<T2 P1>P2 正反应吸热
C、T1>T2 P1>P2 正反应放热 D、T1>T2 P1<P2 正反应放热
17. 在一定条件下的密闭容器中A、B两种物质进行反应2A+B![]() 3C,三者均为气体,下列说法不正确的是B
( )
3C,三者均为气体,下列说法不正确的是B
( )
A、 反应开始时正反应速率最大,逆反应速率为零
B、 随反应的进行,正反应速率逐渐减小,最后为零
C、 随反应的进行,逆反应速率逐渐增大,最后不变
D、 随反应的进行,以A的浓度变化表示的此反应的速率,逐渐减小,最后为零
18.一定温度时于密封容器中发生反应:mA(g)+nB(g) ![]() pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是( )
pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是( )
 |
A.平衡向正反应方向移动 B.C气体的质量分数增大
C.气体A的转化率降低 D.m+n>p
三、填空题
19.(12分)t℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生如下反应:
3A(g)+B(g)![]() xC(g),2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4
xC(g),2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 ![]() ,请填写下列空白:
,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_____________________;
(2)x=________;
(3)一定条件下,若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________;
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)一定条件下,若向原平衡混合物的容器中再充入a mol C后,化学平衡(填字母)________;
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
此时B物质的量分数 (填“变大”或“变小”或 “不变”);
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为____________________.
20.(7分)反应3Fe(s) + 4H2O(g)
![]() Fe3O4(s) +
4H2(g),在一可变容积的密闭容器中进行,试回答:
Fe3O4(s) +
4H2(g),在一可变容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是
(填增大、不变、减小、,以下相同)
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)保持体积不变,充入N2使体系的压强增大,其正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
21.(8分)在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 ;
(2)A、C是气体,增加B的量,平衡不移动,则B为 态;
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 ;
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
22.(9分) 将等物质的量的A和B混合于2 L的密闭容器中,发生如下反应:
3A(气)+B(气)![]() xC(气)+2D(气),经5
min后达到平衡时,测知D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol/(L·min),则A的平衡浓度为_________,B的平均反应速率_______________和x等于__________。
xC(气)+2D(气),经5
min后达到平衡时,测知D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol/(L·min),则A的平衡浓度为_________,B的平均反应速率_______________和x等于__________。
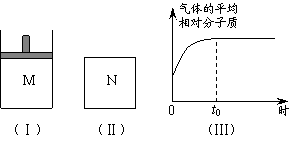
23.(8分)如下图,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下
反应并达到化学平衡状态:2
A(?)+B(?)![]() x C(g);ΔH<0平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
x C(g);ΔH<0平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
| 可能的情形 | A、B是否为气态 | z与y的大小关系 | M(B)与M(C)的大小关系 (M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | z = y | 前面的结论与此无关 |
| ② | ||||
| ③ | ||||
四、计算题
24、(10分)在一定条件下可发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。现取3L二氧化硫和6L氧气混合,当反应达到平衡后,保持温度和压强不变,测得混合气体的体积减小10%。
2SO3(g)。现取3L二氧化硫和6L氧气混合,当反应达到平衡后,保持温度和压强不变,测得混合气体的体积减小10%。
求:(1)二氧化硫的转化率。
(2)平衡混合气体中三氧化硫的体积分数。