高二化学上学期期中测试题
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试时间为90分钟。
可能用到的相对原子质量:
H:1 O:16 Na:23 Al:27 Cl:35.5
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意)
![]() 1.在2A+B 3C+4D中,下列表示该反应的速率最快的是 ( )
1.在2A+B 3C+4D中,下列表示该反应的速率最快的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
2.下列措施对水的电离无影响的是 ( )
A.升高温度 B.加入稀醋酸 C.加入醋酸钠 D.加入食盐
3.金属有很广泛的用途,熔点最低的金属A,常用来做温度计的材料;而熔点最高的金属B,
常用来做白炽灯的灯丝,A、B分别是 ( )
A.Ag、Pt B.Hg、Pt C.Hg、W D.Hg、Fe
4.镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业上制造镁粉是将镁蒸气在某种气
体中冷却,有下列气体:①空气 ②二氧化碳 ③氩气 ④氢气 ⑤氮气,其
中可作为冷却气体的是 ( )
A.①② B.②③ C.③④ D.③④⑤
5.下列说法正确的是 ( )
A.反应物分子的每次碰撞都能发生化学反应
B.活化分子之间的碰撞一定是有效碰撞
C.能够发生化学反应的碰撞是有效碰撞
D.增大反应物浓度时,活化分子百分数增大
6.下列属于水解离子方程式且正确的是 ( )
![]()
![]() A.HCO3-、H2O
H3O++CO32- B.NH3+H2O NH4++OH-
A.HCO3-、H2O
H3O++CO32- B.NH3+H2O NH4++OH-
![]()
![]() C.CO32-+2H2O H2CO3+2OH- D.Al3++3H2O Al(OH)3+3H+
C.CO32-+2H2O H2CO3+2OH- D.Al3++3H2O Al(OH)3+3H+
7.下列叙述正确的是 ( )
A.常温下铝和浓硫酸、浓硝酸不反应
B.工业上常利用铝热反应冶炼难熔的金属,如钒、铬、锰等
C.合金的熔点一般比组成它的各成分的熔点都高
D.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应时,产生的氢气前
者较多
8.向Na2CO3溶液中滴入2滴酚酞试液,溶液呈浅红色,微热后溶液的颜色将 ( )
A.变深 B.变浅 C.不变 D.褪去
二、选择题(本题包抱10小题,每小题3分,共30分。每小题有一个或两个选项符合题意)
9.对于处于化学平衡的体系,下列叙述中正确的是 ( )
A.化学反应速率发生变化,化学平衡一定发生移动
B.化学平衡发生移动,化学反应速率一定发生变化
C.平衡体系的温度发生变化,化学平衡一定发生移动
D.平衡体系的压强发生变化,化学平衡一定发生移动
![]() 10.一定量O2和一定量SO2在密闭容器中发生反应:2SO2+O2 2SO3达到平衡时,O2和
10.一定量O2和一定量SO2在密闭容器中发生反应:2SO2+O2 2SO3达到平衡时,O2和
SO2的转化率相比 ( )
A.O2的转化率大 B.相等 C.SO2的转化率大 D.不能确定
11.能说明醋酸是弱电解质的是 ( )
A.醋酸钠溶液显碱性
B.用食醋可以除热水瓶内的水垢
C.pH=2的醋酸溶液稀释1000倍后pH小于5
D.用浓H2SO4和醋酸钠固体共热可制得醋酸
12.容积固定为3L的某密闭容器中加入1molA、2molB,一定温度下发生如下反应:
![]() A(s)+2B(g)
C(g)+D(g),经反应5min后,测得C的浓度为0.3mol/L。下列说法中正
A(s)+2B(g)
C(g)+D(g),经反应5min后,测得C的浓度为0.3mol/L。下列说法中正
确的是 ( )
A.5min内D的平均反应速率为0.02mol·(L·min)-1
B.5min内B的平均反应速率为0.12mol·(L·min)-1
C.经5min后,向容器内再加入C,正反应速率变小
D.平衡状态时,生成1molD的同时生成1molA
13.向某溶液中加入含Fe2+的溶液后,无明显变化。当再加入几滴新制氯水后,混合液变成
红色,则下列结论中错误的是 ( )
A.该溶液中一定含SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化为Fe3+
14.某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是 ( )
A.Cl-、NO3-、Ba2+、Na+ B.Na+、K+、SO42-、Cl-
C.NH4+、Ba2+、Cl-、HCO3- D.SO42-、CH3COO-、Al3+、Mg2+
15.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加
入过量的稀盐酸,完全反应后,离子数目没有变化的是 ( )
A.Fe3+ B.Fe2+ C.Al3+ D.NH4+
16.将下列物质的溶液,加热蒸干并灼烧,能够得到原来物质的是 ( )
A.FeCl3 B.NaHCO3 C.硫酸镁 D.Na2CO3
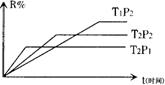
![]() 17.在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L此反应符合下列图象(R%为R
17.在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L此反应符合下列图象(R%为R
|
A.正反应是吸热反应,L是气体
B.正反应是放热反应,L是气体
C.正反应是吸热反应,L是固体
D.正反应是放热反应,L是固体或液体
18.恒温下,在容积固定的密闭容器中充入1mol HI达到平衡时,I2(g)的体积分数为x。若再
向该容器中充入1mol HI并再次达到平衡时,I2(g)的体积分数为y,则x与y的大小关系
为 ( )
A.x>y B.x<y C.x =y D.无法判断
第Ⅱ卷(非选择题,共54分)
三、(本题包括2小题,共13分)
19.(5分)以试管和胶头滴管为仪器,用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制
的NaOH溶液反应制备白色的Fe(OH)2沉淀。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
②生成白色Fe(OH)2沉淀的操作是 ,
这样做的理由是 。
20.(8分)某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:
A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2—3滴酚酞指示剂。
B.用待测的NaOH溶液润洗碱式滴定管。
C.把滴定管用蒸镏水洗净。
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻
度“0”以上2cm—3cm处,把酸式滴定管固定好,调节液面。
E.检查滴定管是否漏水,并分别固定在滴定管架两边。
F.另取锥形瓶,再重复滴定操作一次。
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直
至终点,记下滴定管的液面所在刻度。
据上述滴定操作,完成下列填空:
①滴定操作的正确操作顺序是(用上述各编号字母填写)
→E→ →B→ → → ;
②G步操作中判断滴定终点的依据是 ;
③D步骤的操作中液面应调节到 ,尖嘴部分应 ;
④酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会 ;碱式滴定管
未用待测的NaOH溶液润洗,待测NaOH溶液的测定值会 。(填“偏高”、
“偏低”或“无影响”。)
|
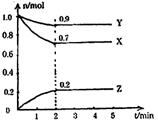
21.(10分)某温度时,在一个2L的密闭容器中,X、
Y、Z三种物质的物质的量随时间的变化曲线如图所
示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不
与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新
平衡时,容器内混合气体的平均相对分子质量比原平衡时 (填“增大”、“减
小”或“相等”)。
(3)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚
集状态是 。
22.(10分)室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。
(1)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减
小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和
溶液的pH。试填写表中空白:
| 离子浓度由大到小的顺序 | 溶质的化学式 | 溶液的pH | |
| ① | c(NH4+)>c(Cl—)>c(OH-)>c(H+) | pH>7 | |
| ② | c(NH4+)=c(Cl-) | NH4Cl、NH3·H2O | |
| ③ | NH4Cl | pH<7 | |
| ④ | c(Cl—)>c(H+)>c(NH4+)>c(OH-) | pH<7 |
 23.(8分)根据下列图示,回答:
23.(8分)根据下列图示,回答:
(1)写出A、B的化学式:A B
(2)写出①、②的化学反应方程式:
①
②
五、(本题包括2小题,共13分)
24.(4分)将pH=1的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓
度相同的一适量NaOH溶液后,所得溶液中H+的物质的量浓度均为0.01mol/L。则加入
的水与NaOH溶液的体积比为(假定液体混合时体积有加和关系) 。
25.(9分)称量一盛有200ml AlCl3溶液的烧杯,总质量为300g;当向AlCl3溶液中投入一
定质量的钠,待钠完全反应后,再次称量烧杯总质量为304.4g(忽略液体的溅出和水分
的挥发);经分析知烧杯内有1.17g沉淀物生成,求烧杯内原AlCl3溶液的物质的量浓度。
(计算结果保留两位有效数字)
参考答案
一、1.B 2.D 3.C 4.C 5.C 6.D 7.B 8.A
二、9.BC 10.D 11.AC 12.BD 13.B 14.B 15.C 16.CD 17.B 18.C
三、19.(5分)(1)H2SO4、Fe(2分)
(2)用长滴管吸取NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液;(2分)
避免生成的Fe(OH)2沉淀接触O2(1分)
20.(8分)(1)C、D、A、G、F(2分)
(2)当滴加最后一滴时,锥形瓶中溶液由红色突变为无色,且半分钟内不恢复,即为滴
定终点(2分) (3)刻度“0”或“0”以下;充满溶液或无气泡(每空1分)
(4)偏高 偏低 (每空1分)
![]() 四、(28分)21.(10分)(1)3X+Y 2Z (2)①0.9 ②放热;减小
四、(28分)21.(10分)(1)3X+Y 2Z (2)①0.9 ②放热;减小
(3)固态或液态 (每空2分,共10分)
22.(10分)(1)增大,减小 (2分) (2)①NH4Cl、NH3·H2O; ②pH=7
|
23.(8分)(1)C,Fe2O3 (2)①2Mg+CO2 2MgO+C
②4Fe(OH)2+O2+2H2O=4Fe(OH)3 (每空2分,共8分)
五、(13分)
24.(4分)11:1
25.(9分)2Na+2H2O 2NaOH+H2↑ △m
46g 2mol 2g 44g
n(NaOH) 304.4g-300g=4.4g
![]() (2分)
(2分)
生成的沉淀物为Al(OH)3,其物质的量为![]() (1分)
(1分)
(1)当Al3+以Al(OH)3和AlCl3形式存在时,尚余NaOH为:
![]() 此种情况不可能(2分)
此种情况不可能(2分)
(2)当Al3+全部变为Al(OH)3和NaAlO2时
n(Al3+) =n[Al(OH)3]+n(NaAlO2)
=![]() =0.054mol (3分)
=0.054mol (3分)
![]() (1分)
(1分)