高二级化学化学平衡单元检测题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷(第1题至18题),第Ⅱ卷(第19题至27题)。共(100+20)分,考试时间110分钟。
第I卷(选择题 共54分)
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合
题意)
1、对于某一可逆反应来说,使用催化剂的作用是:
A.提高反应物的转化率
B.增大正反应速率,减小逆反应速率
C.同等程度地改变正逆反应的速率
D.改变平衡混合物的组成
2、决定化学反应速率的主要因素是:
A.反应物浓度 B.反应温度
C.使用催化剂 D.反应物的性质
3、可逆反应达到平衡的重要特征是:
A.正逆反应速率相等 B.正逆反应速率均为零
C.正逆反应都还在继续进行 D.反应停止了
4、可逆反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是:
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是:
A.V(A)=0.15mol/(mol·s) B.V(B)=0.6mol/(mol·s)
C.V(C)=0.5mol/(mol·s) D.V(D)=0.4mol/(mol·s)
5、在HNO2溶液中存在如下平衡:HNO2![]() H++NO2- ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是:
H++NO2- ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是:
A.NaOH溶液 B.硫酸溶液
C.NaNO2溶液 D.NaHSO4溶液
6、将固体NH4I置于密闭容器中,在某温度下发生下列反应:
NH4I(s)![]() NH3(g)
+ I(g) ;2HI(g)
NH3(g)
+ I(g) ;2HI(g)![]() H2(g)+I2(g)当反应达到平衡时[I2]=1.0摩/升,[HI]=2.5摩/升,则NH3的浓度为:
H2(g)+I2(g)当反应达到平衡时[I2]=1.0摩/升,[HI]=2.5摩/升,则NH3的浓度为:
A.3.5摩/升 B.4摩/升 C.4.5摩/升 D.5摩/升
7、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度
下发生反应:2SO2+O2![]() 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,
乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率:
A.等于p% B.大于p% C.小于p% D.无法判断
8、下列说法正确的是:
A.可逆反应的特征是正反应速率总是和逆反应速率相等
B.在其它条件不变时,使用催化剂只能改变正逆反应速率,而不能改变化学平衡状态
C.在其它条件不变时,升高温度可以使化学平衡向着放热反应的方向移动
D.在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
9、反应:X(g)+3Y(g)![]() 2Z(g)
△H﹤0(正反应为放热反应),在不同温度、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为:
2Z(g)
△H﹤0(正反应为放热反应),在不同温度、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为:
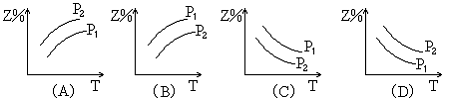 |
10、有一处于平衡状态的反应:A(g)+3B(g)![]() 2C(g);△H﹥0(正反应为吸热反
应)。为了使平衡向生成C的方向移动,应选择下列的适宜条件是:
2C(g);△H﹥0(正反应为吸热反
应)。为了使平衡向生成C的方向移动,应选择下列的适宜条件是:
①高温 ②低温 ③高压 ④低压 ⑤加催化剂
⑥除去C
A.①④⑥ B.②③⑤ C.①③⑥ D.②③⑥
11、某温度下,反应H2(g)+I2(g) ![]() 2HI(g)在密闭容器中达到平衡,缩小容器体积,
2HI(g)在密闭容器中达到平衡,缩小容器体积,
使压强增大,则:
A.平衡逆向移动 B.平衡正向移动
C.容器内H2的质量分数增大 D.容器内气体颜色加深
12、在一密闭容器中,用等物质的量的A和B发生如下反应:
A(气)+ 2B(气) ![]() 2C(气),反应达到平衡 时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为:
2C(气),反应达到平衡 时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为:
A.40% B.50% C.60% D.70%
13、在一个体积为a L的密闭容器中,放入2 L 气体A和1L气体B,在一定条件下
发生反应:3A(g)+ B(g)![]() n C(g)+2 D(g)反应达平衡后,A的浓度减小到原来的1/2
n C(g)+2 D(g)反应达平衡后,A的浓度减小到原来的1/2
,混合气体的平均相对分子质量增大了1/8,则化学方程式中的n值是:
A.1 B.2 C.3 D.4
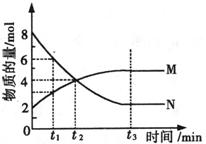 14、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是:
14、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是:
A.反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
15、1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)![]() b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
A. a=1,b=2 B. a=2,b=1 C.a=2,b=2 D. a=3,b=2
16、在一定温度下的定容密闭容器中,能够表明反应:A(s)+ 2B(g)![]() C(g)+ D(g)
C(g)+ D(g)
已达到平衡的是:
A.混合气体的总压强不在变化 B.混合气体的密度不在变化
C.气体的总物质的量不在变化 D.V(B)= 2V(C)
17、将1 molNH3充入一真空密闭容器中,在一定条件下NH3部分分解达到平衡,此时NH3
的体积分数为x%。若在相同条件下的另一同体积容器中,最初投入2 molNH3,反应达到平
衡时,NH3的体积分数为y%,则x和y的正确关系是:
A.x > y B.x < y C.x = y D.x ≥ y
18、往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) ![]() 2HI(g);△H>0(正
2HI(g);△H>0(正
反应为吸热反应),当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且
造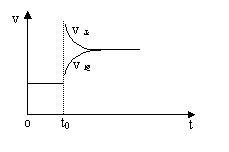 成容器内压强增大,下列说法正确的是:
成容器内压强增大,下列说法正确的是:
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象为(如右图)
Ⅰ卷答案栏
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
| ||||||||
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
第II卷 (非选择题共46分)
二、填空题(本题包括5小题,共34分)
19、(8分)反应3Fe(s)+ 4H2O(g)![]() Fe3O4(s)+4H2(g),在一个容积可变的的密闭容器中进行,试回答:(第1空2分,其余各1分)
Fe3O4(s)+4H2(g),在一个容积可变的的密闭容器中进行,试回答:(第1空2分,其余各1分)
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
③保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
④保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
20、(8分)2A![]() B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1) 若温度升高,平衡向正反应方向移动,则正反应是______热反应;
(2) 若B、C是固体,降低压强时,平衡向逆反应方向移动,则A呈_______态;
(3) 若A是气态时,加压时,平衡不移动,则B为______态,C为_____态。
21、(4分)在一定温度和压强的密闭容器中,充入平均式量为8.5的H2和N2的混合气体,当反应达到平衡时,测出平衡混合气体的平均式量为10,此时N2的转化率____________,平衡混合气体中NH3的体积分数________。
22、(12分)恒温下,将a mol N2 与b mol H2的混合气体通入一个固定容积的密闭容 器中,发生如下反应:N2(g)+ 3H2(g)![]() 2NH3(g)
2NH3(g)
⑴若反应进行到某时刻t时,n2(N2)=13 mol ,n2(NH3)=6 mol 则a 的值_________
⑵反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25﹪。则平衡时NH3的物质的量_____________
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n(始):n(平)=________________
⑷原混合气体中,a:b=___________
⑸达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=_________________
⑹平衡混合气体中,n(N2):n(H2):n(NH3)=_____________________
23、(2分)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为::NH3+HClO![]() H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因:
___________________________________________________________
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因:
___________________________________________________________
24、(6分)已知在硫酸工业中
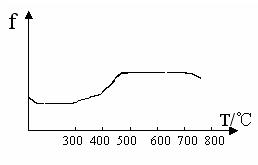 ①SO2转化为SO3的反应为:2SO2 + O2
①SO2转化为SO3的反应为:2SO2 + O2 ![]() 2SO3 △H﹤0(正反应为放热反应)。
2SO3 △H﹤0(正反应为放热反应)。
②经测定,在常压下上述反应的平衡混合气体中,SO3的体积分数为91﹪。
③催化剂的催化效率f与温度T有如下图关系。
④经除尘去杂后的SO2 气体的温度约为200℃,反应后的SO3气体的温度约为600℃。
请根据以上信息,选择SO2转化为SO3的适宜生产条件
三、计算题(6分)
25、(6分)在一容积为500ml的密闭容器中,充入5molH2和2mol的CO.在一定温度、一定压强下,发生如下反应:2H2(g)+ CO(g) ![]() CH3OH(g),经5min后到达平衡状态,若此时测得CH3OH蒸气的浓度为2mol·L-1
CH3OH(g),经5min后到达平衡状态,若此时测得CH3OH蒸气的浓度为2mol·L-1
求:(1)以H2的浓度变化表示的该反应的速度;
(2)达到平衡时CO的转化率。
四、附加题(本题包括2小题,26小题7分,27小题13分,共20分)
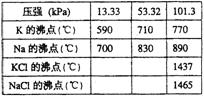 26、(7分)钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
26、(7分)钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l)![]() NaCl(l)+K(g)△H>0(正反应为吸热反应)该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见右表。
NaCl(l)+K(g)△H>0(正反应为吸热反应)该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见右表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低 温度约为 ,而反应的最高温度应低于 _。(2分)
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 ___________
________________________________。(3分)
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= _______
27、(13分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(g)+B(g)![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为
mol。(1分)
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。(2分)(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。(2分)
平衡时,B的物质的量 (选填一个编号)(2分)
A.大于2 mol B.等于2 mol
C.小于2 mol D.可能大于、等于或小于2mol
作出此判断的理由是 。(2分)
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数
是 。(2分)
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上
述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比
较 ___________(选填一个编号)。(2分)
A.a<b B.a>b C..a=b D.不能比较a和b的大小
答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | D | A | C | A | C | B | B | C |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| C | D | A | A | D | D | B | B | D |
二、19、(1)不变;(2)增大、增大;(3)不变、不变;(4)减小、减小
20、(1)吸;(2)气;(3)气、气
21、30%、17.6%
22、(1)16mol (2)8mol (3)5:4 (4)2:3 (5)3:3:2
23、加入液氨时,平衡正移将不稳定的HClO转变为稳定的NH2Cl贮存起来,当杀菌消耗HClO时,平衡又逆向移来补充,从而延长了消毒时间。
24、常压、500℃、催化剂
25、(1)V(H2)=0.8mol/(L·min) (2)50%
26、(1)770℃、890℃ (2)不断移走K(g)、降低压强、适当降温
(3)K=c(K)/c(Na)
27、(1)1-a (2)3a (3)x= 2 y=3-3a ; D ;n(B)=3 – 3a 0﹤a﹤1,当a=1/3时就等于2,当a大于1/3时就小于2,当a小于1/3时就大于2
(4)a/(2-a)×100%
(5)B