高二级化学化学平衡单元检测题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷(第1题至18题),第Ⅱ卷(第19题至23题)。共110分,考试时间100分钟。
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1、本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是:
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
2、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是:
A.对该反应体系加热 B.不用稀硫酸,改用98%浓硫酸
C.加入少量NaHSO4固体 D.不用铁片,改用铁粉
3、对于反应M+N![]() P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为:
P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为:
A.2 min B.3 min C.6 min D.9 min
4、反应![]()
![]()
![]() 在10L密闭器中进行,半分钟后,水蒸气的量增加了0.45mol,则此反应的平均速率
在10L密闭器中进行,半分钟后,水蒸气的量增加了0.45mol,则此反应的平均速率![]() 可表示为:
可表示为:
A.![]() B.
B.![]()
 C.
C.![]() D.
D.![]()
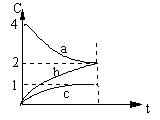
5、800℃时,a、b、c三种气态物质的浓度随时间变化的情况如右图,由图分析不能得出的结论是:
A.a是反应物
B.正反应是一个体积扩大的反应
C.若升高温度,a的转化率增大
D.若增大压强,a的转化率减小
6、在密闭容器中进行下列反应2A+3B![]() 2C,开始时,C的浓度为a mol·L—1
,2 min时,C的浓度变为2a mol·L—1,A和B的物质的量浓度均变为原来的1/2,则下列说法中错误的是:
2C,开始时,C的浓度为a mol·L—1
,2 min时,C的浓度变为2a mol·L—1,A和B的物质的量浓度均变为原来的1/2,则下列说法中错误的是:
A.用B表示的反应速率是0.75a mol·(L·min)—1
B.反应开始时,c(B)=3a mol·L—1
C.反应2 min时,c(A) = 0.5a mol·L—1
D.反应2min时,A的转化率为50%
7、一定温度下,某密闭容器中的反应为:aX(g)+bY(g)![]() cZ(g)+dW(g),经5min达到平衡,X减少n
mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则
cZ(g)+dW(g),经5min达到平衡,X减少n
mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则![]() 为:
为:
A.3:1:2:1 B.1:3:2:2 C.1:3:1:2 D.3:1:2:2
8、在一个固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2![]() N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是:
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是:
A.x>y B.x<y C.x = y D.不能确定
9、在温度一定时, 于密闭容器中发生可逆反应: mA(g) + nB(g) ![]() pC(g), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则下列叙述中正确的是:
pC(g), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则下列叙述中正确的是:
A.平衡向正反应方向移动 B.C气体的体积分数增大
C.气体A的转化率升高 D.m + n < p
10、某恒容密闭容器中, 放入一定量的NO2, 发生下列反应: 2NO2(g) ![]() N2O4(g);ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均分子量减小的是:
N2O4(g);ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均分子量减小的是:
A.通入N2 B.通入NO2 C.降低温度 D.通入N2O4
11、一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是:
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是:
A.保持温度和容器体积不变,充入1molSO3(g)
B.保持温度和容器内压强不变,充入1molSO3(g)
C.保持温度和容器内压强不变,充入1molO2(g)
D.保持温度和容器内压强不变,充入1molAr(g)
12、密闭容器中进行如下反应: X2(g) + Y2(g)![]() 2Z(g), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
2Z(g), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
A.Y2 为 0.2 mol/L
B.Y2 为 0.35 mol/L
C.X2 为 0.2 mol/L
D.Z 为 0.4 mol/L
13、已经建立化学平衡的可逆反应: A + B![]() C, 改变条件, 使化学平衡向正反应方向移动, 有关叙述中正确的是:
C, 改变条件, 使化学平衡向正反应方向移动, 有关叙述中正确的是:
A.生成物的百分含量(即质量分数)一定增大 B.生成物的产量一定增大
C.反应物的转化率都增大 D.反应物的百分含量都降低
14、在一定条件下,合成氨反应达到平衡后,混和气体中NH3的体积占25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值为:
A.1/5 B.1/4 C.1/3 D.1/2
15、在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:
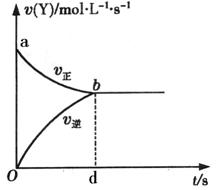 X(g)+2Y(g)
X(g)+2Y(g)![]() 2Z(g)达到平衡,以Y的浓度改变表示的化学反应速率
2Z(g)达到平衡,以Y的浓度改变表示的化学反应速率![]() 、
、![]() 与时间的关系如右图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积):
与时间的关系如右图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积):
A.![]()
B.![]()
C.![]()
 D.
D.![]()
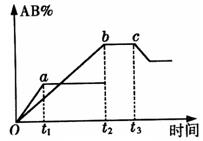
16、反应![]()
![]() 2AB在不同温度和压强改变条件下,产物AB的生成情况,如右图所示:a为500℃,5.05×105Pa,b为300℃,5.05×105Pa时情况,c为300℃时从时间
2AB在不同温度和压强改变条件下,产物AB的生成情况,如右图所示:a为500℃,5.05×105Pa,b为300℃,5.05×105Pa时情况,c为300℃时从时间![]() 开始向容器中加压的情况,则下列叙述正确的是:
开始向容器中加压的情况,则下列叙述正确的是:
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
17、一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为
2Z(g),若X、Y、Z起始浓度分别为![]() (均不为0),当达到平衡时X、Y、Z的浓度分别为
(均不为0),当达到平衡时X、Y、Z的浓度分别为![]() 、
、![]() 、
、![]() ,则下列判断不合理的是:
,则下列判断不合理的是:
A.![]()
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.![]() 的取值范围为
的取值范围为![]()
18、一定温度下,反应2SO2+O2![]() 2SO3,达到平衡时,n(SO2)::n(O2)::n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是:
2SO3,达到平衡时,n(SO2)::n(O2)::n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是:
A.0.4 mol
B.0.6 mol
C.0.8 mol
D.1.2 mol
化学平衡单元检测题
Ⅰ卷答案栏
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
| ||||||||
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
第II卷 (非选择题共56分)
二、填空题(本题包括4小题,共45分)
19、(12分)按题目的要求写出可能采取的措施。对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g)
pC(g)+qD(g)
(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:
① ,②若 ,则可改变压强。
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变_______________
或是单独改变 。
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:
① _____________ ,②若 ___________ ,则可改变压强。
20.(10分)反应![]()
![]()
![]() 在不同温度下,
在不同温度下,![]() 的平衡压强如下表:
的平衡压强如下表:
| 温度/℃ | 550 | 650 | 750 | 850 | 897 |
| 压强/Pa | 5.32×10 |
|
|
|
|
根据上表数据,填写下列空白:
(1)若升高原![]() 的分解平衡体系的温度,同时给反应容器加压,则原平衡:( )
的分解平衡体系的温度,同时给反应容器加压,则原平衡:( )
A.向逆反应方向移动
B.向正反应方向移动
C.不移动
D.无法确定平衡移动方向
 (2)在一个不与外界进行热交换的密闭器中足量的
(2)在一个不与外界进行热交换的密闭器中足量的![]() 在850℃时建立分解平衡。若将该容器的容积扩大为原来的2倍,需重新达到平衡时,容器内的温度将_______________,
在850℃时建立分解平衡。若将该容器的容积扩大为原来的2倍,需重新达到平衡时,容器内的温度将_______________,![]() 的分解率将_________,
的分解率将_________,![]() 的平衡压强将________
的平衡压强将________![]() (填“>”、“=”、“<”),其理由是_________________________________________________。
(填“>”、“=”、“<”),其理由是_________________________________________________。
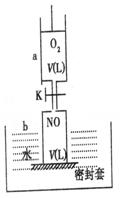
21、(15分)如右图(a中活塞的质量与筒壁的摩擦力不计;与K相连的细管的体积也忽略不计)。在标准状况下:
(1)b中气体与水不接触,打开K,足够长时间后,a中气体体积减少范围是:______△V(减小)_____
(2)在上述(1)之后,快速推a中活塞至a中气体全部进入b中,观察到的现象是________________________________________________,
原因是_______________________________________________________________。
(3)若固定a中活塞如上图所示,打开K,移走b的密封套,足够长时间后,观察到的现象是_________________________________________________________________,
所得溶质的物质的量浓度为(设溶质不扩散到水槽中)__________________________
22、(8分)已知t℃、101kPa时容积可变的密闭容器中充入2molA和1molB,此时容器的体积为V L,发生反应2A(g)+B(g) ![]() 2C(g),达平衡时,C的体积分数是0.4。
2C(g),达平衡时,C的体积分数是0.4。
(1)若恒温恒压时,开始充入4molC,达平衡时C的体积分数是 __ ,容器的体积为 L。
(2)若另选一容积不变的密闭容器,仍控制温度为t℃,开始充入4molA和2molB,反应达平衡时C的体积分数是0.4,压强为101kPa。则该容器的体积为 L。
三、计算题(11分)
23、把2.5 mol A和2.5 mol B混合盛入2L容积的密闭容器里发生反应3A(g)+B(g)![]() xC(g)+2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为
xC(g)+2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为![]() ,同时生成1 mol D。试求:
,同时生成1 mol D。试求:
(1)达平衡时B的转化率;
(2)试算x的值;
(3)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | B | A | C | C | C | D | A | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | B | B | B | A | B | B | C | A |
19、(1)加入催化剂,m + n = p + q
(2)反应物浓度;生成物浓度
(3)改变温度,m + n ≠ p + q
20、(1)D
(2)降低;增大;<;增大体积使![]() 的浓度减小,平衡向右移动,由于正反应是吸热反应,故体系的温度降低,重新达到平衡时,
的浓度减小,平衡向右移动,由于正反应是吸热反应,故体系的温度降低,重新达到平衡时,![]() 的压强必小于850℃的平衡压强
的压强必小于850℃的平衡压强
21、(1)![]()
(2)红棕色气体颜色变深后又变浅;a中气体进入b中后,![]() 浓度增大,颜色加深,又因为
浓度增大,颜色加深,又因为![]() (红棕色)
(红棕色)![]()
![]() (无色),当
(无色),当![]() 浓度增大(或气体压强增大)时,平衡正向移动,
浓度增大(或气体压强增大)时,平衡正向移动,![]() 浓度又降低,红棕色又变浅
浓度又降低,红棕色又变浅
(3) a、b中气体由无色逐渐变为红棕色,溶液(或水)缓慢进入b中,最终充满b,且a中充液约![]() ;剩余气体为无色气体
;剩余气体为无色气体![]() 或
或![]() 或
或![]() (无单位不得分)
(无单位不得分)
22、(1)0、4,5V/3 (2)5V/3
23、(1)20% (2)x=4 (3)2.4L