高二选修化学上学期月考试题
命题:李梅 时间:100分钟 分值:120分
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括7小题,每题4分,共28分。每小题只有一个选项符合题意)
1. 下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl B.2KClO3=2KCl+3O2↑
C.2Na2O2+2H2O=4NaOH+O2↑ D.Ba(OH)2·8H2O+2 NH4Cl=BaCl2+ NH3↑+10H2O
2.一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,用时将它们混合并用手揉搓就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测肯定错误的是( )
A.Na2SO4·10H2O脱水是吸热过程
B.Na2SO4·10H2O与NH4NO3在该条件下发生的复分解反应是吸热反应
C.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
D.NH4NO3溶于水会吸收热量
3.X、Y、Z、M代表四种金属,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气析出;若电解含Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为 ( )
A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y
4用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前浓度的是
( )
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
5.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)=![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是 ( )
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是 ( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
6.能使水的电离平衡右移,且水溶液呈碱性的是 ( )
A.Ba2+ B.Al3+ C.OH- D.CO32-
7.一定温度下,将a mol PCl5通入一个容积不变的密闭容器中,发生反应:PCl5(g) ![]()
PCl3(g)+Cl2(g),平衡时测得混合气体的压强为p1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为p2,下列判断正确的是 ( )
A.2p1>p2 B.PCl5的分解率增大 C.p1>p2 D.Cl2的体积分数增大
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确 答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但选错一个该小题就为0分)
8.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+1/2 O2(g)=CO(g) △H= — 393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H= + 571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= — 890.3 kJ/mol
D.1/2 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) △H= —1400 kJ/mol
9.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:
5HClO2 → 4ClO2↑ + H+ + Cl- + 2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,速度变化的原因是
A.逸出ClO2使生成物浓度降低 B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用 D.溶液中的Cl-起催化作用
10.25℃时,0.1mol/L的一元酸HA溶液和0.1mol/L的一元碱BOH溶液的pH之和为13,现将两溶液等体积混合,下列有关叙述中正确的是:
A.酸HA溶液的pH可能为1 B.混合溶液中c(A-)=c(B+)
C.混合溶液显碱性 D.碱BOH一定是弱碱
11.在100mL 0.1mol/L的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是
A.加入少量Na2CO3固体 B.加入少量CH3COONa固体
C.加入少量的0.05mol/L的硫酸 D.加入少量NaCl溶液
12.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:
A(固)+2B(气)![]() C(气)+D(气)已达平衡的是 ( )
C(气)+D(气)已达平衡的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均分子量
13.在373K 时,把0.5 mol N2O4气体通入体积为5 L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是( )
A.前2 s,N2O4的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含NO2 为0.04 mol·L-1
D.平衡时,N2O4的转化率为60%
14.用质量均为100g的铜做电极,电解AgNO3溶液。电解一段时间后,两电极上的质量差为28g。则两极的质量分别为 ( )
A.阳极100g,阴极128g B.阳极93.6g,阴极121.6g
C.阳极91.0g,阴极119.0g D.阳极86.0g,阴极114.0g
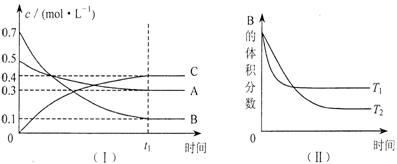
15.T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图I所示;若保持其他条件不变,温度分别为Tl和T2时,B的体积百分含量与时间的关系如图Ⅱ所示。则下列结论正确的是
![]()
![]()
 A.在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动
A.在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动
B.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.保持其他条件不变,若反应开始时A、B、C的浓度分别为0.4mo1·L—1、
0.5 mo1·L—1和0.2 mo1·L—1,则达到平衡后,C的浓度大于0.4 mo1·L—1
D.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
第Ⅱ卷(非选择题 共60分)
三、(本题包括2小题,共14分)
16. (1) (4分)下列有关实验操作或判断不正确的是 _________(填有关序号,选错倒扣分)。
A.用10 ml量筒量取稀硫酸溶液 8.0 mL
B.进行中和热测定实验时,只要测出反应前NaOH溶液的温度和反应后溶液的最高温度即可
C.用碱式滴定管量取KMnO4溶液 19.60 ml
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.取0.1mol·L-1的MgCl2溶液0.1mol·L-1的AlCl3溶液,测其PH大小,以证明Mg的金属性比Al强.
(2)(10分)充满HCl的烧瓶做完喷泉实验后得到的稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,清你问答下列问题:
①用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在 式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从 色变为 色;
②现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第 种。
①2.500mo1.L—l ②0.25 mo1.L—1 ③0.025 mo1.L—1
③若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):
c(HCl)= 。
四、(本题包括4小题,共34 分)
17.(6分)在10℃和2×105Pa条件下,反应aA(g) +fF(g)= dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强下反应建立平衡时物质D的浓度:
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| D的浓度(mol/L) | 0.085 | 0.20 | 0.44 |
根据表中数据回答下列问题:
(1)压强2×105 Pa增加到5×105 Pa时,平衡向 (填“正”或“逆”)反应方向移动,其理由是 .
(2)压强从5×105Pa增加到1×106Pa时,平衡向 反应方向移动(填“正”或“逆”),
其理由是 .
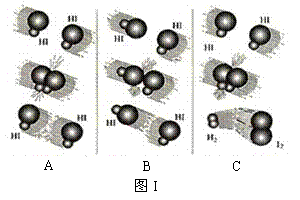 18.(10分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
18.(10分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
⑴ 图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞 (选填“A”、“B”或“C”);
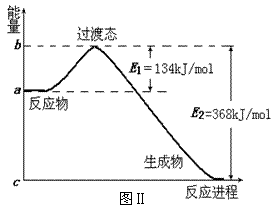 ⑵ 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
⑵ 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____________________________
________________________________;
⑶ 过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
⑷ 进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/ kJ·mol–1 | 197 | 360 | 499 | X |
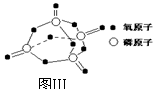
 已知白磷的燃烧热为2378.0
kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X= 。
已知白磷的燃烧热为2378.0
kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X= 。
19.(8分)将2molI2(g)和1molH2置于某2L密闭容器中,在一定温度下发生反应:
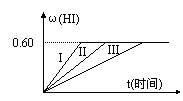
I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示。
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示。
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
20.(10分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1溶液中的水的电离程度小于A2溶液中水的电离程度;B1溶液中的水的电离程度小于B2溶液中水的电离程度;
(1)请写出化学式:A1_______A2_______B1_______B2__________.
(2)相同条件下,当A1、B1的物质的量浓度相同时,两溶液中水电离出的H+的物质的量浓度之比为________________.
(3)B1溶液中的水的电离程度小于B2溶液中水的电离程度,原因是
___________________________________________________________________.
|
|
(4)若B1、B2两溶液PH=5,则两溶液中水电离出的H+的物质的量浓度之比为_________________.
五、(本题包括2小题,共 12 分)
21.用铂电极电解NaCl和CuSO4的混合溶液,当电路通过4mol电子时,在阴阳两极上都产生了1.4mol的气体,电解后溶液的体积为4L。试计算:
(1)电解后溶液的pH。
(2)溶液中NaCl和CuS04的物质的量之比。
(3)另取一NaCl和CuS04的混合溶液,电解足够长时间后溶液呈中性,则溶液中NaCl和CuSO4的物质的量之比为?
高二化学月考试卷答案(选修)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | C | B | A | B | A | D | A |
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | D | AD | AD | A | BD | B | AC |
16.⑴ BC
⑵① 碱 红 橙
② ③
③
17.⑴逆 压强增大2.5倍,而D浓度增加2。3倍,压强增大的倍数大于D浓度增大的倍数
⑵正 加压使物质E液化,引起平衡正向移动
18. (1) C (2) CO(g)+NO2(g)==CO2(g)+NO(g) ΔH=-234kJ/mol (4) 433.75
 (3)
(3)
![]()
![]()
19.(1) 0.55mol·L-1 (2) ③⑤ ① (3) 4b+c=2a
20.(1)A1 NaOH A2 NaNO2 B1 HNO3 B2 NH4NO3 (2) 1:1
(3) H+抑制电离 NH4+促进电离 (4) 1:104
21.⑴13
⑵8:3
⑶2:1