苏教版高二化学反应原理过关检测试题
一.选择题(每小题只有一个选项符合题意)
1.用惰性电极进行电解,下列说法正确的是:
A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B、电解稀氢氧化钠溶液,要消耗OH—,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
2.在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)![]() N2O4(g) △H<0。把烧
N2O4(g) △H<0。把烧
瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A、①和③ B、②和④ C、④和⑤ D、③和⑤
3.在容积为2升的密闭容器中,有反应:mA(g)+nB(g) ![]() pC(g)+qD(g),
pC(g)+qD(g),
经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速
度VB=a/15mol·L-1·min-1,C增加了2a/3 mol·L-1,这时,若增加系统压强,发现
A与C的百分含量不变,则m︰n︰p︰q为
A、3︰1︰2︰2 B、1︰3︰2︰2 C、1︰3︰2︰1 D、1︰1︰1︰1
4.下列说法中正确的是
A、凡是放热反应都是自发的,吸热反应都是非自发的
B、自发反应一定是熵增大,非自发反应一定是熵减小或不变
C、熵增加且放热的反应一定是自发反应
D、非自发反应在任何条件下都不能实现
5.人体血液的pH保持在7.35~7.45,适量的CO2可维持这个pH变化范围,可用下面化
学方程式表示:H2O+CO2![]() H2CO3
H2CO3![]() H++HCO—3。又知人体呼出的气体中CO2体积
H++HCO—3。又知人体呼出的气体中CO2体积
分数约5%。下列说法正确的是
A、太快而且太深的呼吸可以导致碱中毒(pH过高)
B、太快而且太深的呼吸可以导致酸中毒(pH过低)
C、太慢而且太浅的呼吸可以导致酸中毒(pH过低)
D、太慢而且太浅的呼吸可以导致碱中毒(pH过高)
6.已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) △H =-351.1kJ·mol-1
O2(g)=ZnO(s) △H =-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) △H =-90.7 kJ·mol-1
O2(g)=HgO(s) △H =-90.7 kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为
A、-260.4 kJ·mol-1 B、-441.8 kJ·mol-1
C、260.4 kJ·mol-1 D、441.8 kJ·mol-1
7.本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是
A、化学反应速率理论是研究怎样在一定时间内快出产品
B、化学平衡理论是研究怎样使用有限原料多出产品
C、化学反应速率理论是研究怎样提高原料转化率
D、化学平衡理论是研究怎样使原料尽可能多地转化为产品
8.下列电离方程式中正确的是
A、Na2HPO4溶于水:Na2HPO4=2Na++H++PO43-
B、NaHSO4熔化:NaHSO4=Na++H++SO42-
C、HF溶于少量水中:2HF![]() H++HF2一
H++HF2一
D、(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一
9.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─= CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2─ = CuS↓
次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是 ( )
A、CuS <Cu(OH)2<CuCO3 B、CuS >Cu(OH)2>CuCO3
C、Cu(OH)2>CuCO3>CuS D、Cu(OH)2<CuCO3<CuS
10.pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为(单位:mol·L-1)
A、![]() ×(4×10-9+1×10-12)
B、
×(4×10-9+1×10-12)
B、![]() ×(8×10-9+1×10-12)
×(8×10-9+1×10-12)
C、5×10-10 D、5×10-12
二. 选择题(每小题有一个或两个选项符合题意)
11.在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A、混合气体的压强 B、混合气体的密度
C、B的物质的量 D、气体总物质的量
12.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
A、由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B、由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C、由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D、由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
13.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,各投入0.65 g锌粒,则下图
所示比较符合客观事实的
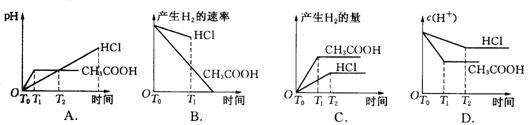
14.目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx![]() 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是
A、放电时,Na 作正极,S极发生还原反应
B、充电时钠极与外电源的正极相连
C、当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠2.3g
D、充电时,阳极发生的反应为:Sx2--2e-=xS
15.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
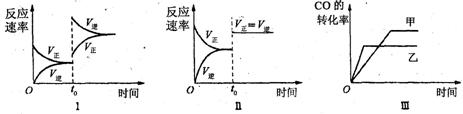 |
下列分析中不正确的是
A、图Ⅰ研究中的是t0时升高温度对反应速率的影响
B、图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
16.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高
纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A、阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
17.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A、同物质的量浓度的三种溶液的pH:a>b>c
B、同pH时,三种溶液稀释相同倍数后,pH:a=b<c
C、同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
18.实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l,0.1 mol/L某一元碱(BOH)溶液里:C(H+)/C(OH—)=10—12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
A、C(B+)>C(A—)>C(OH—)>C(H+) B、C(A—)>C(B+)>C(H+)>C(OH—)
C、C(B+)+C (H+)=C(A—)+C(OH—) D、C(B+)>C(A—)>C(H+)>c(OH—)
19.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A、滴加石蕊试液显红色的溶液:Fe3+ 、NH4+ 、Cl- 、I-
B、pH值为1的溶液:Cu2+、Na+ 、Mg2+、NO3-
C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D、所含溶质为Na2SO4的溶液:K+ 、CO32-、NO3-、Al3+
20.某溶液中只含有Na+、H+、OH—、A—四种离子,下列说法正确的是
A、若溶液中c(A—)= c(Na+),则溶液一定呈中性
B、溶液中不可能存在:c(Na+)> c(A—)> c(OH—)> c(H+)
C、若c(OH—)> c(H+),溶液中不可能存在:c(Na’)> c(OH—)> c(A—)> c(H+)
D、若溶质为NaA、HA,则一定存在:c(A—)> c(Na+)> c(H+)> c(OH—)
三.填空题
21.在一定温度下,有1mol N2气体和3mol H2气体发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)若在相同温度下,分别在1L定压密闭容器A中和1L定容密闭容器B中反应:
哪个容器中的反应先达到平衡? 答: 。
哪个容器中的N2的转化率高? 答: 。
(2)若在上述定压密闭容器A中,反应已达到平衡时,再加入0.5摩氩气,则N2的
转化率会起什么变化?答: 。
正反应速度与原平衡相比,有无变化,简答理由。
。
(3)若在1L定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质
的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3
的加入的物质的量(mol),使达到平衡后N2、H2、NH3的物质的量也为A、B、C摩。
则应满足的条件是:
①若x=0,y=0,则z= 。
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是 。
22.在2L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)![]() 2C
2C
(g)+D(s),达到平衡时,C的浓度为0.4mol·L-1。
(1)温度不变,若缩小容器体积,则平衡 移动(填“正向”、“逆向”、“不”)。
(2)维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol·L-1的是 。
A、4molA+2molB B、2molC+1molD
C、2molA+1molB+2molC+1molD D、1molA+0.5molB+1molC+0.2molD
(3)若维持容器的温度和体积不变,按不同配比加入起始物质,达到平衡时, C的浓度仍是0.4mol·L-1。
①反应从逆反应开始,则D的起始物质的量应满足的条件是 。
②若加入0.2molA和0.1molB,则C和D起始物质的量分别应满足 、 。
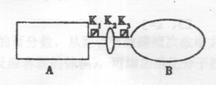 23.A是由导热材料制成的密闭容器,B是一耐化学腐
23.A是由导热材料制成的密闭容器,B是一耐化学腐
蚀且易于传热的气球.关闭K2,将等量且少量的
NO2通过K1、K3分别充入A、B中,反应开始时,A、
B的体积相同。已知:
2NO2(g)![]() N2O4(g) △H<0。
N2O4(g) △H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不 变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 ;
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将 。
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 。
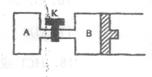 24.如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起
24.如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起
始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生下
列反应:2X(g)+2Y(g)![]() 3Z(g)+2W(g)(正反应是放热反应),达到平衡(Ⅰ)
3Z(g)+2W(g)(正反应是放热反应),达到平衡(Ⅰ)
时,V(B)=1.2aL。请回答:
(1)B中X的转化率α(X)B为 ;
(2)打开K,过一段时间重新达到平衡(Ⅱ)时,B的体
积为 (用的代数式表示,连接管中气体体积不
计)。
25.某二元酸H2A的电离方程式是:H2A=H++HA-,HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)Na2A溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(2)NaHA溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)若0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能 0.11mol·L-1(填“<”、“>”或“=”),理由是: ;
(4)0.1mol·L-1NaHA溶液中各离子浓度由大到小的顺序是 。
26.如图所示,若电解5min时铜电极质量增加2.16g,
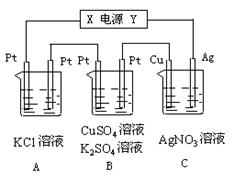 试回答:
试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化:A池________,B池_______,
C池________。
⑶ 通过5min时,B中共收集224mL气体(标
况),溶液体积为200mL,则通电前硫酸铜溶
液的物质的量浓度为______________。
⑷ 若A中KCl溶液的体积也是200mL,电解
后溶液的pH = ______。
四.实验题
27. 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的五处错误。
① ,② ,③ ,④ ,⑤ 。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
A、转移待测液至容量瓶时,未洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读数(滴定管)开始时仰视,终点时俯视
28.用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合
液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂),试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3沉淀溶解而能测
定NaOH的含量? 。
(2)滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则能否由此准确
地计算出结果? 。
(3)能否改用甲基橙作指示剂? ,若用甲基橙作指示剂,则测定结果如何? 。
五.计算题
29.常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为多少?
30.有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出24mL用0.025mol/LH2SO4
滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:
(1)当滴到沉淀不再增加时,溶液的pH(设体积可以加和)。
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度。
参考答案:
1、D 2、D 3、A 4、C 5、C 6、AC 7、C 8、D 9、A 10、D
11、BC 12、C 13、AC 14、D 15、C 16、D 17、A 18、AC 19、B 20、A
21、(1)A A (2)减小 减小 在其它条件不变的情况下,降低压强减小反应速率(3)①2 ②2.25 0.5 ③2x+z=2 2y+3z=6
22、(1)正向 (2)BD (3)①n(D)>0.6mol ②n(C)=1.8mol n(D)>0.5mol
23、(1)< 变小(2)增大 不变 变小(3)A (4)0.02mol
24、80% 0.8aL
25、(1)碱性 A2-+H2O![]() HA-+OH-
(2)酸性 HA-
HA-+OH-
(2)酸性 HA-![]() H++A2-
H++A2-
(3)< H2A第一步电离产生的H+对HA-的电离起了抑制作用
(4)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
26、⑴ 负极 ⑵ 增大,减小,不变 ⑶ 0.025mol/L ⑷ 13
27、(1)①未冷却就转移,②烧杯未洗涤,③未用玻璃棒引流,④未用胶头滴管滴加至刻度线,⑤未振荡、摇匀。
(2)酸式 ,0刻度以下
(3)碱式滴定管、锥形瓶,酚酞,浅红色,无
(4)80%
(5)A、C、E
28、(1)用酚酞作指示剂,滴定终点pH>7,碳酸钡不能溶解
(2)不能,不能准确读出所用标准盐酸的体积(活塞处无刻度)
(3)不能,偏高
29、2.4
30、(1)12.4 (2)0.025mol·L-1 0.050mol·L-1