机密★2个月 姓名 准考证号
高中毕业化学会考试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1页至第4页,第Ⅱ卷 第5页至第8页。满分100分。考试时间100分钟。
第Ⅰ卷(选择题 共50分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号用蓝(黑)色钢笔或圆珠笔填写在试卷和答题卡上;同时将准考证号和考试科目用2B铅笔填涂在答题卡上。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试卷上。
3.考试结束,监考人将本试卷和答题卡一并收回。
相对原子质量:H 1 C 12 N 14 O16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1.下列物质中,硫元素的化合价最低的是
A.H2S B.S
C.SO2 D.SO3
2.下列各组物质中,互为同位素的是
A.O2和O3 B.21H和31H
C.CO和CO2 D.CH4和C3H8
3.下列化合物中,只有离子键的是
A.NH4Cl B.NaOH
C.KCl D.NH3
4.下列气体中,只能用排水法收集的是
A.氨气 B.氯气
C.二氧化硫 D.乙烯
5.下列物质中,既能与氢氧化钠溶液反应,又能与盐酸反应的是
A.NH4Cl B.Al(OH)3
C.Na2CO3 D.KNO3
6.从1997年5月起,我国已有许多城市先后开始发布城市空气质量日报。在下列物质中,不属于大气污染物的是
A.SO2 B.NO2
C.CO2 D.可吸入颗粒物
7.下列物质中,不能与水发生反应的是
A.SiO2 D.NO2
C.Na2O2 D.CaO
8.下列反应中,HCl既作氧化剂又作还原剂的是
A.CuO+2HCl==CuCl2+H2O
B.NaOH+HCl==NaCl+H2O
|
D.2HCl====H2↑+Cl2↑
9.下列物质的溶液中,加入淀粉溶液时,溶液颜色无变化;再滴加氯水,溶液会变蓝的是
A.NaCl B.NaBr
C.KI D.I2
10.下列元素原子半径最小的是
A.Si B.P
|
11.某有机物的结构为CH2==CHCH—CHO,下列对其化学性质的判断中,不正确的是
A.能被银氨溶液氧化
B.能使溴水褪色
C.能使高锰酸钾酸性溶液褪色
D.能与新制的氢氧化铜反应生成黑色沉淀
12.下列元素最高价氧化物所对应水化物的碱性最强的是
A.Li B.Na C.K D.Cs
13.用下列方法不能将NaCl和Na2CO3两种溶液区分开的是
A.向两种溶液中分别滴加醋酸
B.向两种溶液中分别滴加稀硫酸
C.向两种溶液中分别滴加氯化钡溶液
D.向两种溶液中分别滴加硝酸银溶液
14.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
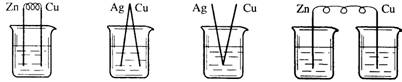
A B C D
15.20 mL0.5 mol/LAlCl3溶液与10mL3 mol/LNaCl溶液中的Cl—的物质的量浓度之比为
A.1:1 B.2:1
C.1:2 D.1:3
16.某化合物的性质如下:①加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体;②溶于水,加入硝酸钡溶液,产生能溶于稀硝酸的白色沉淀。则该物质是
A.NH4Cl B.(NH4)2CO3
C.NaCl D.K2SO4
17.下列气态氢化物中,最稳定的是
A.HF B.HCl
C.HBr D.HI
18.下列物质中,不能发生水解反应的是
A.蔗糖 B.淀粉
C.葡萄糖 D.纤维素
19.在常温下,相同物质的量浓度的CH3CH2ONa溶液的pH大于CH3COONa溶液的pH,则CH3CH2ONa溶液呈
A.酸性 B.碱性
C.中性 D.无法确定
20.0.1 mol某气态烃在氧气中完全燃烧,生成2.24 LCO2(标准状况)和3.6 g H20,则该烃的分子式是
A.CH4 B.C2H2
C.C2H4 D.C2H6
21.下列各组离子,能在溶液中大量共存的是
A.A13+、Na+、Cl—、OH— B.Na+、H+、OH—、CO32—
C.K+、NH4+、SO42—、NO3— D.K+、Ba2+、OH—、SO42—
22.下列各反应达到化学平衡后,增大压强或降低温度,都能使化学平衡向正反应方向移动的是
A.C(s)+CO2(g)![]() 2CO(g)
(正反应为吸热反应)
2CO(g)
(正反应为吸热反应)
B.3O2(g)![]() 2O3(g)
(正反应为吸热反应)
2O3(g)
(正反应为吸热反应)
C.CO(g)+NO2(g)![]() CO2(g)+NO(g) (正反应为放热反应)
CO2(g)+NO(g) (正反应为放热反应)
D.N2(g)+3H2(g)![]() 2NH3(g) (正反应为放热反应)
2NH3(g) (正反应为放热反应)
23.下列反应的离子方程式,书写正确的是
A.二氧化硫与水反应:SO2+H2O==2H++SO32—
B.碳酸钙与盐酸反应:CaCO3+2H+==Ca2++CO2↑+H2O
C.铜与浓硝酸反应:Cu+2H+==Cu2++H2↑
D.硫酸与氢氧化钡溶液反应:Ba2++SO42—==BaSO4↓
24.元素的性质随着原子序数的递增呈现周期性变化的原因是
A.元素原子的核外电子排布呈周期性变化
B.元素原子的电子层数呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子半径呈周期性变化
25.要除去下列物质中的杂质,所采用的方法错误的是
A Fe粉中混有的少量Al粉,加足量的NaOH溶液,过滤
B.Cl2中混有的少量HCl,通过盛有足量NaOH溶液的洗气瓶,洗气
C.SiO2中混有的少量Fe2O3,加足量的稀盐酸,过滤
D.NO中混有的少量NO2,通过盛有足量水的洗气瓶,洗气
第Ⅱ卷(选择题 共50分)
| 题号 | 二 | 三 | 四 | 五 | 总分 |
| 分数 |
相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Ba 137
二、填空题(本题包括3小题,共15分)
26.(5分)在3517Cl原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 ,在这个反应中,氯气是 剂(填“氧化’,或“还原”)。
27.(2分)在常温下,物质的量浓度均为0.2mol/L的下述物质的溶液:①HNO3 ②NaOH ③CH3COONa ④KCl ⑤NH4Cl,其中c(H+)最大的是 ,c(OH—)最大的是 。
28.(8分)乙烯是石油化学工业最重要的基础原料,一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一。请根据下图中有机物的相互转化关系,回答有关问题。
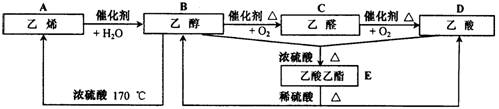 |
(1)请写出下列有机物官能团的名称。
①—OH ②—CHO ③—COOH
(2)写出下列有机物间转化的反应类型。
①A→B ②B+D→E ③B→C
④B→A ⑤E→B+D
三、简答题(本题包括3小题,共14分)
29.(4分)写出下列反应的化学方程式。
(1)实验室加热二氧化锰和浓盐酸的混合物制氯气的反应
(2)在加热的条件下,铜和浓硫酸的反应
(3)实验室加热乙醇和浓硫酸的混合物制乙烯的反应
(4)实验室加热氯化铵和氢氧化钙的混合物制氨气的反应
30.(2分)写出下列反应的离子方程式。
(1)碳酸钠溶液与足量盐酸反应
(2)醋酸钠的水解反应
31.(8分)下表列出了①〜⑥六种元素在周期表中的位置:
|
周期 | ⅠA |
| 0 | |||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
请按要求回答下列问题。
(1)写出下列标号元素的元素符号:① ⑤ ;
(2)元素①形成的最简单的有机物的空间构型为 ;
(3)元素②的最高价氧化物对应水化物的分子式为 ;
(4)元素③所形成的两种氢化物的分子式分别为 和 ;
(5)元素④的氯化物的电子式为 ;
(6)元素⑥的单质在氧气中燃烧的化学方程式是 。
四、实验题(本题包括2小题,共11分)
32.(4分)某实验小组的同学为探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。
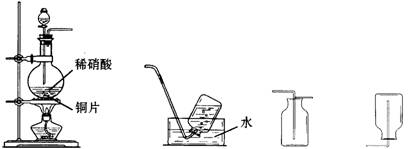 |
A B C D
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是A接 。
(2)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式: 。
在实验过程中,该小组同学采用了微热的方法,目的是 。
(3)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因: 。
33.(7分)某同学为探究碳酸钠的性质,进行了如下实验,请你按要求回答有关问题。
(1)配制100 mL 0.5 mol/L的Na2CO3溶液。该同学应用天平称量Na2CO3固体的质量
为 g。在配制该溶液时,要用到的玻璃仪器有 、 、
和 。
(2)用pH试纸测所配溶液的pH,pH>7,说明Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”);用试管取少量所配溶液,向溶液中滴加几滴酚酞试液,溶液变红,再用酒精灯加热,溶液的颜色变深,说明升高温度,对Na2CO3的水解有 作用。
五、计算题(本题包括2小题,共10分)
34.(4分)1.0mol/L的NaOH溶液中,c(OH—)为 mol/L;取此溶液20 mL,向其中加入0.5mol/L的H2S04溶液,当恰好完全中和时,消耗H2SO4溶液的体积为 mL。
35.(6分)某含(NH4)2SO4和K2SO4的混合溶液100mL,向其中滴加足量的Ba(OH)2溶液,加热,充分反应,生成的气体在标准状况下体积为448 mL,将反应后的溶液过滤得白色沉淀4.66 g。求原混合溶液中K2SO4的物质的量浓度。
 族
族