高二化学9月月考试卷
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27
Cl:35.5 Cu:4 Ag:108
一、选择题(本题包括8小题,每小题2分,共16分.每小题只有一个选项符合题意)
1. 下列反应中生成物总能量低于反应物总能量的是( )
A.氢气还原三氧化钨 B.高锰酸钾分解
C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
2.下列说法正确的是( )
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数不变,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
![]() 3.对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是(
)
3.对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是(
)
A.v(NH3)= 0.2mol·L-1·s-1 B.v(O2 )= 0.24 mol·L-1·s-1
C.v(H2O )= 0.25 mol·L-1·s-1 D.v(NO) = 0.15 mol·L-1·s-1
4. 在密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是(
)
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是(
)
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
5.在一个绝热的体积一定的密闭容器中发生可逆反应:
N2(g) + 3H2(g) ![]() 2NH3(g)
; △H<0
2NH3(g)
; △H<0
下列各项中不能说明该反应已经达到平衡状态的是 ( )
A.体系的压强不再改变
B.体系的温度不再改变
C.断裂1mol N≡N键的同时,也断裂6molN—H键
D.反应消耗的 、与产生的的速率υ() : υ() : υ() == 1∶3 ∶2
6.已知热化学方程:
2KNO3(s) = 2KNO2(s) +O2(g);△H = +58kJ/mol
C(s) +O2(g) = CO2(g);△H =-94kJ/mol
为提供分解1molKNO3所需的能量,理论上需完全燃烧碳( )
A.58/94mol B.58/(94×2) mol C.(58×2)/94mol D.(94×2)/58mol
7.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H =-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H =-2869kJ/mol
下列说法正确的是( )
A、正丁烷分子储存的能量大于异丁烷分子 B、正丁烷的稳定性大于异丁烷
C、异丁烷转化为正丁烷的过程是一个放热过程 D、 异丁烷分子中的碳氢键比正丁烷的多
8.已知热化学反应方程式:
Zn(s)+![]() O2(g)
O2(g)![]() ZnO(s);ΔH= —351.5
kJ·mol-1
ZnO(s);ΔH= —351.5
kJ·mol-1
Hg(l)+![]() O2(g)
O2(g) ![]() HgO(s);ΔH= —90.84
kJ·mol-1
HgO(s);ΔH= —90.84
kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
![]() ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A. ΔH= +260.7 kJ·mol-1 B. ΔH= —260.7 kJ·mol-1
C. ΔH= —444.2 kJ·mol-1 D. ΔH= +444.2 kJ·mol-1
二、选择题(本题包括10小题,每小题3分,共30分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
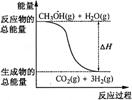 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
下列说法正确的是( )
A CH3OH的燃烧热为192.9kJ·mol-1
B 反应①中的能量变化如右图所示
C CH3OH转变成H2的过程一定要吸收能量
D 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>—192.9kJ·mol-1
10.加热装有1
molHI气体的定容密闭容器,在t1 ℃,2HI(g)![]() H2(g)+I2(g);△H<0反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2
molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是 ( )
H2(g)+I2(g);△H<0反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2
molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是 ( )
A.若t1=t2,则x1=x2 B.若t1=t2,则x1<x2 C.若t1<t2,则x2< x1 D.若t1<t2,则x1=x2
11. 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)![]() Sn(s、白)
△H3=+2.1kJ/mol
Sn(s、白)
△H3=+2.1kJ/mol
下列说法正确的是( )
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
12.强酸和强碱稀溶液的中和热可以表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①.HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=a kJ·mol-1
②.1/2H2SO4(浓)+KOH(aq)=1/2K2SO4(aq)+H2O(l);△H=c kJ·mol-1
③.HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=b kJ·mol-1
则a、b、c三者的大小关系为( )
A.a>b>c B.c>b>a C.a=b=c D.a >c> b
![]() 13.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
13.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
![]()
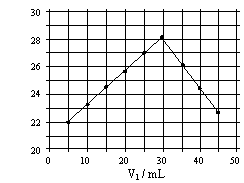 14. 将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
14. 将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
A 做该实验时环境温度为22℃
B 该实验表明化学能可能转化为热能
C NaOH溶液的浓度约为1.0mol/L
D 该实验表明有水生成的反应都是放热反应
15.工业上生产苯乙烯是利用乙苯在560度时的脱氢反应:
C8H10 (g) ![]() C8H8(g)
+ H2(g)
C8H8(g)
+ H2(g)
针对上述反应,有人提出如下观点,其中合理的是( )
A.在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率
C.在乙苯反应达到平衡过程中,体系的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件
16.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g);△H<0
2C(g);△H<0
达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 增大体积 | A的转化率 |
| D | 降低温度 | 混合气体的密度 |
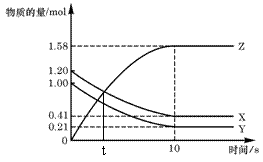 17.一定温度下,在2 L的密闭容器中,X、Y、Z
17.一定温度下,在2 L的密闭容器中,X、Y、Z
三种气体的物质的量随时间变化的曲线如右图,
下列描述正确的是( )
A.t秒时该反应达到化学平衡状态
B.反应开始到10 s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g)![]() 2Z(g)
2Z(g)
18..一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H<0。现将1mol
A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol
A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
A 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t3前的反应速率变化已省略)

图1 图2 图3
三、填空题
19. “碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L- | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol·L- | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t /s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0~44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
20. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
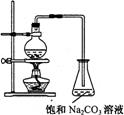 (1)欲提高乙酸的转化率,可采取的措施有:
、
等。
(1)欲提高乙酸的转化率,可采取的措施有:
、
等。
(2)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:
、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A 120℃,4h B 80℃,2h C 60℃,4h D 40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为 。
21. 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量. 已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1.由N2和H2合成1molNH3时可放出46.2kJ的热量. N-H键的键能是______________.
22.在密闭容器中,通入amolN2和bmolH2,在一定条件下达到平衡,容器中还剩余cmolN2.
(1).生成NH3的物质的量为 .
(2).平衡时H2的转化率为 .
(3).若把容器体积减小一半,则正反应速率 ,逆反应速率 ,N2转化率 .(填“变大”、“变小”、或“不变”)
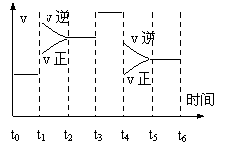 23. 一密闭容器中发生下列反应:
23. 一密闭容器中发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0
下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1). t1、t3、t4时刻,体系中分别是什么条件发生了
变化?
______________________ 、______________________、 ____________________.
(2).下列时间段中,氨的百分含量最高的是_________.
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
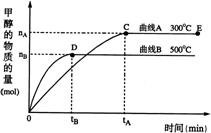 24. 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
24. 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
四、计算题(本题包括2小题,共14分)
25.在温度为373K时,把11.5g
NO2气体通入体积为500ml的真空密闭容器中,发生反应:2NO2(g)![]() N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
⑴.开始时2s内以c (NO2)的变化表示的反应速率是多少?
⑵.达到平衡时体系内的压强是开始的多少倍?
高二化学9月月考试卷参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| C | D | A | B | D | B | A | B | D | AC | D | A | C | B | B | A | CD | BD |
19(共8分)(1)研究反应物I-与S2O82-的浓度对反应速率的影响( 2分)
(2)29.3s (2分)
(3)A (2分)
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)(2分)
20(共10分)(1)增大乙醇的浓度(1分) 移去生成物(1分)
(2)(2分)原料来不及反应就被蒸出 温度过高,发生了副反应 冷凝效果不好,部分产物挥发了(任填两种)
(3)(2分)产生本量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难催化效果不理想(任填两种)
(4)①C ( 2分) ②乙醇脱水生成了乙醚
(2分)
21(共2分).391.6 kJ·mol-1 (2分)
22(共10分).(1).2(a-c)mol (2分) (2).3(a-c)/b (2分)
(3).变大 变大 变大 (每空各2分)
23.(共8分)(1).升高温度 ;加入催化剂 ; 降低压强 (每空各2分) (2). A (2分)
24. (每空各2分,共10分)
(1)K=c(CH3OH)/c(CO)·c2(H2) 减小
(2)2nB/3tBmol·(L·min)-1
(3)b c
(4)Cu2O+CO![]() 2Cu+CO2
2Cu+CO2
25(共8分).(1). 0.1mol/L·s (2).0.8 (各4分)