高二化学上册12月月考试题
一、单项选择题(本题包括8小题,每小题4分共32分。每小题只是一个选项符合题意)
1、下列说法正确的是
A、凡是放热反应都是自发的,吸热反应都是非自发的;
B、自发反应一定是熵增大,非自发反应一定是熵减少或不变;
C、熵增加且放热的反应一定是自发反应 D、自发反应在任何条件下都能实现。
2、下列不能用勒沙特列原理解释的是
A.用排饱和食盐水法收集Cl2
B.棕红色NO2加压后颜色先变深后变浅;
C.打开汽水瓶时,有大量气泡溢出;
D.H2、I2、HI平衡混和气加压后颜色变深。
3、一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.混合气体平均分子量保持不变的状态
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
4、反应 4NH3+5O2 ![]() 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A. V(O2)=0.01mol.L-1.s-1 B. V(NO)=0.008mol.L-1.s-1
C. V(H2O)=0.006mol.L-1.s-1 D. V(NH3)=0.002mol.L-1.s-1
5、现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g)![]() H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中
H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中
甲:n(CO2) = n(H2) = 1 mol; 乙:n(CO2)=1 mol, n(H2)= 2 mol;
丙:n(CO2) = n(H2)=1mol n[H2,O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是
A、乙>甲>丙 B、甲>丙>乙 C、乙>丙>甲 D、甲>乙>丙
6、下列变化过程中,ΔS<0的是
A.氯化钠溶于水中 B.NH3(g)和HCl(g)反应生成NH4Cl
C.干冰的升华 D.CaCO3(S)分解为CaO(S)和CO2(g)
7、可逆反应A+B(g)![]() C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
A. A为固体,C为气体,正反应为放热反应B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应 D. A、C均为气体,正反应为吸热反应
8、一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(S)![]() Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少 B.溶液c(Ca2+)减小
C.溶液的C(OH-)增大 D.溶液中溶质的质量分数增大
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9、合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%。最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2→2NH3,有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新的催化剂降低了反应所需要的能量,提高了活化分子百分数
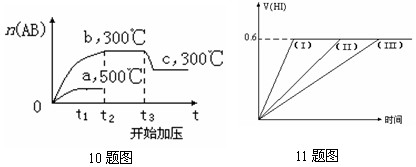
10、可逆反应:A2(?) +
B2(?)![]() 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
A.A2、B2及AB均为气体,Q>0 B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
11、在一定温度下发生反应:![]()
![]()
![]() ;
;![]() 并达平衡。HI的体积分数
并达平衡。HI的体积分数![]() 随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下
随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下![]() 的变化如曲线(I)所示。在乙条件下
的变化如曲线(I)所示。在乙条件下![]() 的变化如曲线(III)所示。则甲条件、乙条件分别是 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度③ 恒温条件下,缩小反应容器体积④
恒温条件下,扩大反应容器体积⑤ 恒温恒容条件下,加入适当的催化剂
的变化如曲线(III)所示。则甲条件、乙条件分别是 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度③ 恒温条件下,缩小反应容器体积④
恒温条件下,扩大反应容器体积⑤ 恒温恒容条件下,加入适当的催化剂
A. ①⑤,③ B. ②⑤,④ C. ③⑤,② D. ③⑤,④
12、对于反应mA(g)+nB(g)![]() pC(g)+qD(g)
满足下列图象,根据图象判断四种关系正确的是
pC(g)+qD(g)
满足下列图象,根据图象判断四种关系正确的是

A.m+n>p+q,正反应吸热 B. m+n<p+q, 正反应放热
C.m+n>p+q,正反应放热 D. m+n<p+q, 正反应吸热
13、右图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g) ![]() N2O4(g);△H<0。则以下说法正确的是
N2O4(g);△H<0。则以下说法正确的是
A.保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B.打开K一会,再关闭它,向右推动活塞时,最后A容器的气体颜色比B的浅
C.打开K一会,再关闭它,把A容器加热,活塞向右移动,A中气体颜色变浅
D.打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
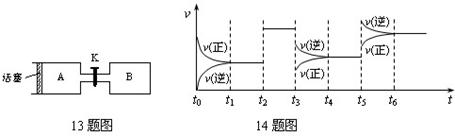
14、某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
15、在锌与某浓度的盐酸起反应的实验中,一个学生得到如下结果:
| 序号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解于酸的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 30 | t1 |
| E | 2 | 薄片 | 35 | 50 |
| F | 2 | 颗粒 | 15 | t2 |
| G | 2 | 粉末 | 15 | t3 |
则下列说法正确的是:①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C.只有② D.全部正确
16、一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
12月月考高二化学试题答题卷
班级_________姓名_____________学号________得分______________
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
![]()
二、不定项选择题(本题包括12小题,每小题4分,共48分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
![]()
三、(本题包括2小题)
17、某温度下SO2的转化反应的平衡常数K=532.4. 2SO2+O2![]() 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表,判断反应方向:
18、下表数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:

*注:a和b均为与温度有关的常数
请填空回答:
⑴金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是
。
⑵金属氧化膜的膜厚Y跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):MgO氧化膜厚Y属 型,NiO氧化膜厚Y′属 型。
⑶Mg与Ni比较,哪一种金属具有良好的耐氧化腐蚀性: ,其理由是:
。
四、(本题包括2小题)
19、反应m A+n B![]() p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是_____。
②若C为气体且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
20、某化学反应 3 A ![]() 2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
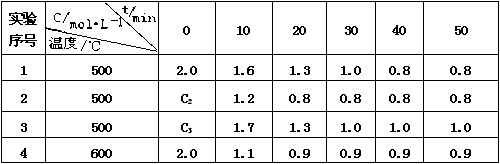
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3 ____v1 (填 <、>或=),且C3 ______ 2.0 mol / L (填 <、>或=)
(4)比较实验 4 和实验 1,可推测正反应是______反应(填吸热或放热)。理由是 ________________________________________
五、(本题包括2小题)
21、某温度下,向某密闭容器中加入相对平均分子质量为8.5的N2和H2的混合气体4mol使之反应合成氨,达平衡后测得NH3的体积分数为m。保持温度不变,只改变起始物质的加入量使反应重新达到平衡后,NH3的体积分数仍为m。若N2、H2、NH3的加入量分别用x、y、z表示,则x、y、z应满足:
①温度、体积恒定时,若x=0,y=0,则z= ;
温度、压强恒定时,若x=0,y=0,则z ;
②温度、体积恒定时,若x=0.75mol,则y= ,z= ;
温度、压强恒定时,若x=0.75mol,则y= ,z ;
③温度、压强恒定时,x、y、z应满足的关系是: 。
22、t℃时,将3molA和2molB气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) ![]() xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)________α(B)(填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C)都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t℃时,若向原平衡混合物的容器中再充人amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充人__________(填A或B)________mol(用a表示),达新平衡时,A的物质的量为n(A)___________(用含a的式子表示)
六、(本题包括2小题)
23、(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 __________
_ ,K值大小与温度的关系是:温度升高,K值_____________ 。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) ![]() CO2(g)十H2 (g);(正反应放热)。CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______
mol/(L·min)
CO2(g)十H2 (g);(正反应放热)。CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______
mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
24、将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。
根据以上资料回答下列问题:
 | |||
 | |||
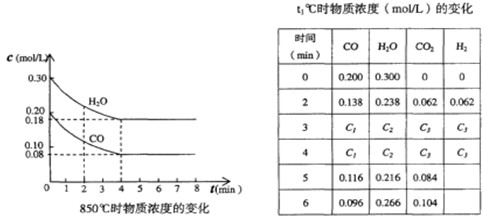
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
___________(选填“A”、“B”或“C”);
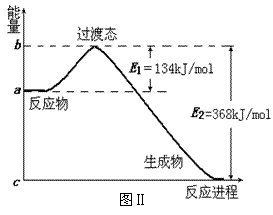
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ___________________________________;
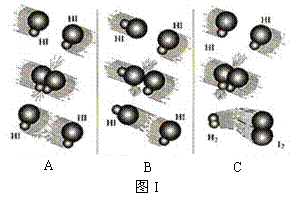
(3) 下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/ kJ·mol–1 | 197 | 360 | 499 | X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则下表中X=_______________________。
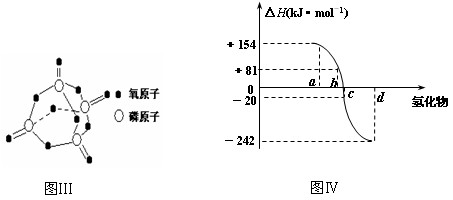
(4)图Ⅳ为氧族元素的氢化物a、b、c、d的生成热数据示意图。请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(△H)之间的关系:___________________。
七、(本题包括2小题)
25、一定温度下C(s)和水蒸气在密闭容器中发生反应,建立化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g);∆H>0。
CO(g)+H2(g);∆H>0。
(1)平衡混合气的平均相对分子质量Mr(平)的取值范围为______>Mr(平)>________。(2)若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气的平均相对分子质量Mr(平)的取值范围为___________>Mr(平)____________。此时若加压,平衡将_____________(向左、向右、不)移动,设原平衡时混合气中气体的物质的量共a mol,加压、重新达到平衡后气体比原来平衡减少b mol,则新平衡时混合气平均相对分子质量Mr'(平)和Mr(平)的关系为Mr'(平)=____________________(用Mr(平),a、b的数字表示。)
(3)在(2)建立的平衡中,①当Mr'(平)=Mr(平)时,Mr(平)=________,此反应开始时,所用CO、H2的物质的量之比__________。②当Mr(平)<_______________时,Mr'(平)<Mr(平),当Mr(平)>__________________时,Mr'(平)>Mr(平)。
(4)由(3)得出结论:从逆反应方向建立平衡时,Mr'(平)与Mr(平)的相对大小主要取决于__________________________________。
26、反应PCl5(g)![]() PCl3 (g)+Cl2 (g) 在某温度下达到平衡时,c(PCl5)=1.00mol/L,c(PCl3)=0.2mol/L,c(Cl2)=0.2mol/L若该平衡体系在温度不变时
PCl3 (g)+Cl2 (g) 在某温度下达到平衡时,c(PCl5)=1.00mol/L,c(PCl3)=0.2mol/L,c(Cl2)=0.2mol/L若该平衡体系在温度不变时
(1)体积增大一倍 (2)总压强减为原来的一半求以上两种情况下,再次建立平衡时氯气的浓度和PCl5平衡时的转化率各为多少?
12月月考高二化学试题答案
一、二选择题
1、C 2、D 3、D 4、D 5、A 6、B 7、B 8、A
9、BD 10、B 11、D 12、C 13、AD 14、A 15、C 16、B
17. (1)逆方向进行 (2)正方向进行 (3)反应已达平衡状态
18、⑴反应速率可以用反应物的消耗速率,也可以用产物的生成速率。⑵直线,抛物线⑶Ni,它的腐蚀速率随时间的增长比镁的要慢。
19、(1) m+n<p (2)逆反应方向 (3)气
20、 ⑴ 0.03 ⑵ 2.0 加入了催化剂 ⑶ > (4)升温度达平衡后A的浓度增大,平衡左移,故正反应为放热反应.
21、① =2mol >0 ② 2.25mol 0.5mol 2.25mol ≥0 ③ y=3x z≥0
22、⑴x=4 ⑵ > ⑶ C ⑷ B a/4 2.4+0.6a
23、(1) 可逆反应的进行程度越大 可能增大也可能减小 (2) 0.03
(3) ①平衡 大于 ②d a
24、(1) C (2)NO2(g)+CO(g)=CO2(g)+NO(g);ΔH=-234 kJ/mol
(3)434(433.75)(4)非金属元素的氢化物越稳定,△H越小,反之亦然
25、(1)18>Mr(平)>15 (2)28> Mr(平)>2 向左 M'r(平)=
(3) ①M'r(平)=12 5:8 ②12 ,12 (4)起始时,CO和H2的物质的量之比
26、0.1362mol/L 7.24% 0.132mol/L 7.9%