高二化学上册阶段考二测试卷
命题人:许承标
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 K-39 Mg—24
Al—27 Fe—56 Zn—65 Ag—108 Cu—64
一、单选题(只有一个选项正确,2×25=50分)
1.工业上制取镁粉是将镁的蒸气进行冷却,冷却的最好方法是:
A.在N2中冷却 B.在H2中冷却 C.在水中冷却 D.在CO2中冷却
2.下列离子反应方程式正确的是:
A.铝溶解在NaOH溶液中:2Al + 2OH― + 2H2O
== 2AlO![]() + 3H2↑
+ 3H2↑
B.氨水滴入AlCl3溶液中:Al3+ + 3OH― == Al(OH)3↓
C.MgO溶于稀HCl中:O![]() + 2H+ == H2O
+ 2H+ == H2O
D.Al(OH)3溶于稀H2SO4中:OH― + H+ == H2O
3.某无色透明溶液,能与铝作用放出氢气,此溶液中可以大量共存的离子组是:
A.H+、Mg2+、Cl―、Ba2+
B.SO![]() 、Na+、HCO
、Na+、HCO![]() 、K+
、K+
C.Cu2+、OH―、SO![]() 、Fe2+
D.NO
、Fe2+
D.NO![]() 、H+、Cl―、Ba2+
、H+、Cl―、Ba2+
4.CH3CH(C2H5)CH(CH3)2的名称是:
A.1,3-二甲基戊烷 B.2-甲基-3-乙基丁烷 C.3,4-二甲基戊烷 D.2,3-二甲基戊烷
5.下列说法不正确的是:
A.煤矿的矿井里常有甲烷(瓦斯)逸出,要采取通风、严禁烟火等措施
B.点燃可燃性气体前不必须验纯
C.沼气的应用对解决农村燃料、改善环境、发展农业生产有重要意义
D.自然界中甲烷主要是由动物残体在隔绝空气的情况下分解而成的
6.在20℃时,某反应速率为0.1mol/(L·S),若该反应温度每升高10℃反应速率增加到原来的3倍,则40℃时其反应速率为:
A.0.6mol/(L·S) B.0.9mol/(L·S) C.1mol/(L·S)D.2mol/(L·S)
![]()
7.合成氨反应N2+3H2 2NH3正反应为放热反应,为增加氨气产量,工厂应采取的正确措施是:
A.高温、高压 B.适宜温度、高压、催化剂
C.高温、低压 D.低温、高压、催化剂
8.将100mL3mol·L―1的NaOH溶液与100mL1mol·L―1AlCl3溶液按下列两种方法混合:(1)将NaOH溶液分多次加到AlCl3溶液中(边加边搅拌)
(2)将AlCl3溶液分多次加到NaOH溶液中(边加边搅拌)
上述两种实验所得正确的结论为:
A.现象相同,沉淀量相等 B.现象相同,沉淀量不等
C.现象不相同,沉淀量相等 D.现象不同,沉淀量不同
9.两种金属混合粉末15g,与足量的盐酸反应时,生成11.2LH2(标况),符合上述情况的金属混合物是:
A.Mg和Ag B.Fe和 Cu C.Al和Mg D.Fe和Zn
10. PH=10的Ba(OH)2溶液与PH=12的NaOH溶液等体积混合,混合液的PH值约为:(已知lg2=0.3)
A.10 B.10.3 C.11.7 D.12.3
11.在K2SO4和Al2(SO4)3的混合溶液中,已知Al3+的浓度为0.2mol/L,SO![]() 的浓度为0.4mol/L,则该溶液中的K+浓度为:
的浓度为0.4mol/L,则该溶液中的K+浓度为:
A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L
12.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中错误的是:
A.由Al、Cu、稀硫酸组成的原电池,其正极反应式为:2H++2e-= H2↑
B.由Al、Mg、NaOH溶液组成的原电池,其负极反应式为:Mg-2e- = Mg2+
C.由Fe、Cu、FeCl3 溶液组成的原电池,其正极反应式为:Fe3++e- = Fe2+
D.由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e- = Cu2+
13.将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入4mol·L-1的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是:
A.125mL B.200mL C.250mL D.560mL
14.下列各组离子在指定溶液中,能大量共存的是:
①无色溶液中:K+,Cl—,Na+,HPO42—,PO43—,SO42—
②PH=3的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—,ClO—
③水电离出的H+浓度C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入铝能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—,NO3—
⑤酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A.①②④ B.①②③ C.①② D.①
15.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为:
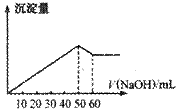 A.6∶1
B.3∶1
A.6∶1
B.3∶1
C.2∶1 D.1∶2
16. 某烷烃的相对分子质量为72,该烷烃的同分异构体共有:
A.4种 B.3种 C.2种 D.1种
17.分子相同的下列溶液:①NH4Cl;②(NH4)2SO4;③NH4HSO4;④NH4HCO3,C(NH4+)由大到小的顺序是:
A.②④①③ B.④①③② C.①④③② D.②③①④
18. 对于可逆反应:mA(g)+nB(s)→p C(g)+qD(g)反应过程中,其它条件不变时,产物D的物质的量分数D%与温度T或压强P的关系如下图,下列说法正确的是:
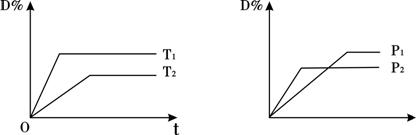
A.降低温度可使化学平衡向正反应方向移动
B.化学方程式中化学计量数:m<p+q
C.使用合适的催化剂可使D%有所增加
D.B的颗粒越小,正反应速率越大,平衡向正反应方向移动
19. 将下列物质的溶液蒸干灼烧能得到原来物质的是:
A.FeCl3 B.FeSO4 C.NaHCO3 D.Al2(SO4)3
20. 把Fe粉、Cu粉置于FeCl3溶液中,充分反应后加入KSCN不现红色,下列情况不能成立的是:
A.铁不剩余,Cu剩余 B.铁、铜均剩余
C.铁剩余,含Cu2+ D.铜剩余,含Fe2+
21. 大多数有机物分子里的碳原子与碳原子或碳原子与其他原子相结合的化学键是:
A.只有极性键 B.只有非极性键
C.有极性键和非极性键 D.只有离子键
22. 下列有关烷烃的叙述中,不正确的是:
A.在烷烃分子中,所有的化学键都为单键
B.所有的烷烃在光照条件下都能与Cl2发生取代反应
C.烷烃的分子通式为CnH2n+2,符合该通式的烃不一定是烷烃
D.随着碳原子数的增加,烷烃的熔沸点一般逐渐升高
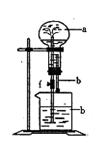 23. 在下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:
23. 在下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol·L-1盐酸 |
24. 下列各反应中,属于水解反应的是:
A.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
B.HPO42-+H2O![]() H3O++PO43-
H3O++PO43-
C.CO32-+H3O+![]() H2O+HCO3-
H2O+HCO3-
D.H2PO4-+H2O![]() OH-+H3PO4
OH-+H3PO4
25. 有下列事实:①X+Y2+══X2++Y
②Z+2H2O![]() Z(OH)2+H2↑ ③氧化性 Z2+<X2+ ④由Y、W两种金属与WSO4溶液组成原电池时,发生的电极反应分别为
:W2++2e-══W和Y-2e-══Y2+。由此判断金属的还原性由强到弱的顺序为:
Z(OH)2+H2↑ ③氧化性 Z2+<X2+ ④由Y、W两种金属与WSO4溶液组成原电池时,发生的电极反应分别为
:W2++2e-══W和Y-2e-══Y2+。由此判断金属的还原性由强到弱的顺序为:
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
二、填空题(本大题包括3小题,共31分)
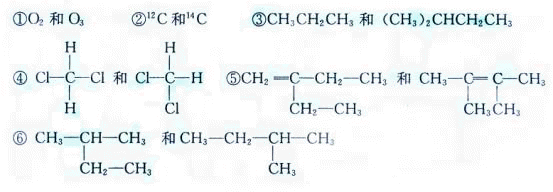 26、(12分)下列各组物质:
26、(12分)下列各组物质:
互为同系物的是_____(填编号,下同)互为同分异构体的是____,互为同位素的是____,互为同素异形体的是_____,属于同一种物质的是_____。
27、(4分)某学生用实验确定某酸HA是弱电解质。其实验方案是:
①量取一定体积HA配制成0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA的弱电解质。
(1)上述实验方案中,说明HA是弱电解质的理由是测得溶液的pH____1(填“>”“<”或“=”)
(2)请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述(从水解的角度思考)。
28、(15分)物质A-J均是中学化学中常见的物质,其相互关系如图所示,已知A、B、C、D、E和F、G、H、I、J中分别含有相同的某一种元素,J物质颜色是红褐色。请填写下列空白:
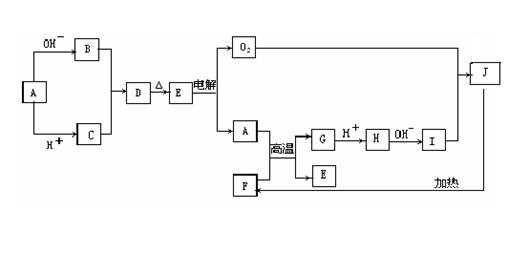 ⑴写出A和OH-反应的离子方程式
,
⑴写出A和OH-反应的离子方程式
,
B和C反应的离子方程式 ;
⑵写出A和F反应的化学方程式: ;
⑶写出I和O2反应的化学方程式: 。暴露在空气中的现象是 。
三、实验题(本大题共10分)
29、(10分)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。方程式如下:
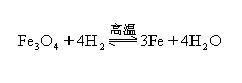
请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁 圈、石棉网、加热设备等在图中均已略去)。
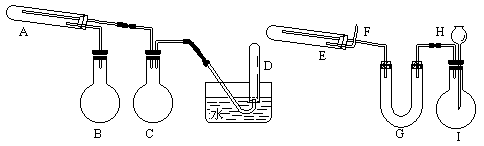
填写下列空白:
(1)实验进行时试管A中应加入的试剂是_______;在试管D中收集得到的是_______。
(2)两套装置中,在实验时需要加热的仪器是_______(填该仪器对应的字母)。
(3)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是__
_____。
(4)试管E中发生反应的化学方程式是______________。
四、计算题(9分)
30、将100mL2mol/lAlCl3溶液跟一定体积的4mol/lNaOH溶液混合后可得7.8g沉淀。则NaOH溶液的体积可能是多少毫升?
 义乌四中高二化学阶段考二答题卷
义乌四中高二化学阶段考二答题卷
26、互为同系物的是_____(填编号,下同)互为同分异构体的是____,互为同位素的是____,互为同素异形体的是_____,属于同一种物质的是_____。
27、(1)、pH____1
(2)、
28、⑴写出A和OH-反应的离子方程式 ,
B和C反应的离子方程式 ;
⑵写出A和F反应的化学方程式: ;
⑶写出I和O2反应的化学方程式: 。暴露在空气中的现象是 。
29、(1)试剂是____
__;D中收集得到的是___
___。
(2)加热的仪器是____
___(填该仪器对应的字母)。
(3)其目的是__
___
_
_。
(4)试管E中发生反应的化学方程式是____
__________。
30、
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | A | A | D | B | B | B | C | A | C | B | B | C | D | D |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |||||
| B | D | B | D | C | C | C | D | D | C |
26.③(2分) ⑤(2分) ②(2分) ①(2分) ④⑥(4分)
27.(4分)⑴>(2分) ⑵配制NaA溶液,测其pH>7,即可证明HA是弱电解质(2分)
28、(每空3分)(1)、2Al+2OH—+2H2O=2AlO2—+3H2↑,
Al3++3 AlO2—+6H2O=4 Al(OH)3↓
(2)、2Al+Fe2O3=2Fe+Al2O3(3)、4Fe(OH)2+O2+2H2O= Fe(OH)3
白色物质迅速变成灰绿色,最后变成红褐色。
![]() 29、(每空2分) (1)普通铁粉, 氢气
29、(每空2分) (1)普通铁粉, 氢气
(2)A、B、E (未全对给1分,有错即不给分)
(3)置换出铜单质,构成了原电池,加快氢气产生的速度
(4)
30、75毫升,175毫升。一个答案正确5分,全对9分。