高二年级化学上学期期中考试试卷
命题人:吴兴国 2006、11、15
可能用到的相对原子质量:
H: 1 C:12 N:14 O:16 P:31 S:32 Cl:35.5 Br:80
Na:23 Mg:24 Al:27 K:39 Fe:56 Cu:64 Ag:108
第Ⅰ卷(共50分)
一、选择题(本题包括25小题,每小题只有一个答案符合题意,每小题2分,共50分)
1.下列电离方程式正确的是
A.醋酸溶于水:CH3COOH =CH3COO- + H+
B.熔融状态下的NaHSO4:NaHSO4 = Na+ + H+ +SO42-
C.碳酸氢钠溶于水:HCO3- +H2O ![]() CO32- + H3O+
CO32- + H3O+
D.硫化氢溶于水:H2S ![]() 2H+ + S2-
2H+ + S2-
2.水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子能电离,则n是( )
A 1×10-4 B 55.6×107 C 1×107 D 6.02×1021
3.某温度下,重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],以下关于pD的叙述正确的是
A.中性溶液中pD=7
B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),其中pD=12
C.在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中pD=2
D.向100mL 0.25mol·L-1的DCl重水溶液中加入50mL 0.2mol·L-1的NaOD的重水溶液,其中pD=2
4.本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
5.在二氧化碳溶于水的平衡体系中,存在以下电离:
H2CO3 ![]() H++HCO3- HCO3-
H++HCO3- HCO3- ![]() H++CO32-,若使溶液的pH增大,则C(CO32-)将 ( )
H++CO32-,若使溶液的pH增大,则C(CO32-)将 ( )
A.增大 B.减小 C.不变 D.可能增大也可能减小
 6.现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于( )
6.现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于( )
A a-lg2 B b-lg2 C a+lg2 D b+lg2
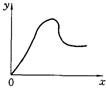
7.向冰醋酸中不断加水时的变化曲线如右图,若x表示加水的量,则y轴可表示为( )
A.导电性 B.H+的物质的量
C.C(OH—) D.C(CH3COOH)的电离程度
8.现有H+ 浓度相同的醋酸溶液和盐酸,分别用蒸溜水稀释至原体积的m倍和n倍,稀释后两溶液的H+ 浓度仍然相等,则m和n的关系是
A.m > n B.m = n C.m< n D.无法确定
9.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5mol/L盐酸
C.0.5mol/L醋酸 D.0.5mol/L氯化钾
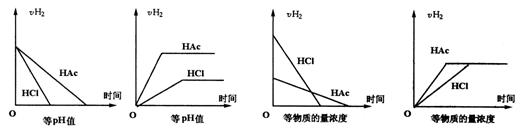 10.分别在等体积等pH或等物质的量浓度的盐酸和醋酸中加入足量镁,产生H2的体积(同温同压下测定)的变化图示如下:
10.分别在等体积等pH或等物质的量浓度的盐酸和醋酸中加入足量镁,产生H2的体积(同温同压下测定)的变化图示如下:
|
其中正确的是:
A.①③ B.② C.① D.②④
11.在N2+3H2![]() 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的平均反应速率为0.45mol/L·s,反应所经过的时间是
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的平均反应速率为0.45mol/L·s,反应所经过的时间是
A.0.44s B.1s C.1.33s D.2s
12.25℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=12,酸碱溶液混合后溶液的pH=7,则酸溶液的体积(V1)与碱溶液的体积(V2)的关系是
A.V1=102V2 B.V2=102V1 C. V1=2V2 D. V2=2V1
13.将pH试纸用蒸馏水湿润后,去测定某溶液的pH,该溶液的pH将会( )
A. 偏高 B. 偏低 C. 不变 D. 上述三种情况均有可能
14.25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2,三种溶液,若测得其中C(NH4+)分别为a、b、c(单位:mol/L),则下列判断正确的是( )
A a=b=c B c>a>b C b>a>c D a>c>b
15.pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.c(NH4+)>c(Cl—)>c(H+)>c(OH—) B.c(NH4+)>c(Cl—)>c(OH—)>c(H+)
C.c(Cl—)>c(NH4+)>c(OH—)>c(H+) D.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
16.已知,K2HPO4溶液呈碱性,在K2HPO4的溶液中存在多个平衡,其中磷酸氢根离子的电离平衡为:![]() H++ ,欲使溶液中 、H+和三种离子的物质的量浓度均减小,可采取的方法是( )
H++ ,欲使溶液中 、H+和三种离子的物质的量浓度均减小,可采取的方法是( )
A.加水 B.加热 C.加氢氧化钠 D.加消石灰
17.某溶液中发生反应:A ==== 2B + C,A的反应速率υ(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
A.图中阴影部分的面积表示0—2min内A
的物质的量浓度的减小值
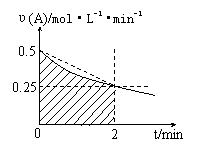 B.反应开始的前2min,A的平均反应速率
B.反应开始的前2min,A的平均反应速率
小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于
0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1 至1.5mol·L-1 之间
18.已知NH4+与HCHO在水溶液中有如下反应:
![]() 4NH4++6HCHO (CH2)6N4+4H++6H2O
4NH4++6HCHO (CH2)6N4+4H++6H2O
现有一失去标签的铵态氮肥,为了测定其含氮量,称取2.00克样品溶于水,加入足量HCHO溶液配成100毫升溶液,再取出10.0毫升,滴入0.100mol·L—1NaOH溶液25.0毫升时恰好完全反应。则该铵盐中氮元素的质量分数为( )
A.35.0 % B.17.8 % C. 21.2 % D.17.5 %
19.在Na2S溶液中,下列粒子之间关系不正确的是
A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)
B.c(Na+)=2[c(S2-) + c(HS-) + c(H2S)]
C.c(OH-)=c(H+) + c(HS-) +2c(H2S)
D.c(Na+) + c(H+)=c(S2-) + c(HS-) + c(OH-)
20.某无色溶液中放入Al片后有H2产生,则下列离子在溶液中肯定可以大量存在的是
A.Na+、Cl-、Ba2+、NO3- B.Na+、Cl-、K+、Br-
C.S2–、Cl-、K+、AlO2- D.HCO3-、Cl-、Ba2+、Na+
21.取某种盐的溶液于三支试管中,分别加入适量的烧碱溶液、纯碱溶液和硫化钠溶液后,三支试管中都生成同样的沉淀。此盐是( )
A. AgNO3 B. FeCl3 C. Al2(SO4)3 D. CuSO4
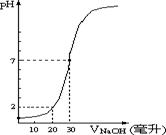 22.下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质量的浓度正确的是( )
22.下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质量的浓度正确的是( )
| A | B | C | D | |
| [HCl](mol/L) | 0.12 | 0.04 | 0.12 | 0.09 |
| [NaOH](mol/L) | 0.04 | 0.12 | 0.06 | 0.03 |
23.向一定量的某一元酸HA溶液中加入一定量强碱MOH溶液,反应后溶液呈中性,则下列判断中正确的是( )
A 反应中所用的酸过量
B 反应生成的盐不水解
C 参加反应的酸HA和碱MOH的物质的量相等
D 反应后的溶液中C(A-)=C(M+)
24.把下列物质的水溶液加热蒸干后,能得到原溶质的是( )
把下列物质的水溶液加热蒸干后,能得到原溶质的是( )
A NaHCO3 B FeCl3 C KCl D Na2SO3
25.常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如右图所示,下列说法正确的是 ( )
A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强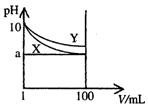
C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
第Ⅱ卷(共50分)
二、填空题(本题共4小题,共42分)
26.(6分)
⑴ (2分) 某温度下纯水的c(H+)=2.0×10-7mol/L。在此温度下,某溶液中由水电离出
的c(H+)为4.0×10-13mol/L,则该溶液的pH值可能是 。
⑵(2分)分别将少量CO2气体通入一元酸的钠盐NaA和NaB的溶液中,发生的反应为:①CO2 +2NaA +H2O ==== Na2CO3+2HA;②CO2 +NaB+H2O ==== NaHCO3 + HB,试由此H2CO3、HCO3-、HA、HB的电离程度由大到小顺序 。
⑶(2分)已知,在相同条件下,HCN的电离程度比HF小。请根据有关知识分析判断,在相同温度下,物质的量浓度相同的NaCN溶液和NaF溶液中:
[c(CN-)+c(OH-)] ______ [c(F-) + c(OH-)](选填“等于”、“大于”或“小于”)。
27.(14分)在一个容积恒定为VL的密闭容器中将0.20molA,0.10molB,0.20molC和0.10molD四种物质进行混合,发生如下反应:aA(g)+bB(g) ![]() cC(s)+dD(g);△H=a kJ/mol在该反应中,a=b=c=d=1,当反应经过5min后达到平衡状态,此时测得混合气体的总物质的最为0.34mol。请回答下列问题:
cC(s)+dD(g);△H=a kJ/mol在该反应中,a=b=c=d=1,当反应经过5min后达到平衡状态,此时测得混合气体的总物质的最为0.34mol。请回答下列问题:
(1)在这段时间内D的化学反应速率为_____mol/(L·min);在该过程中,B的转化率____:
(2)达到平衡时的气体混合物的平均相对分子量与起始状态时相比,变化趋势是______。
(填序号)
①增人 ②减小 ⑧不变 ④以上三种都有可能
作出此判断的理由是______________________。
(3)若给反应体系降温,达到新平衡时气体的总物质的量恢复成原气体总物质的量,则△
H____0:(填>、=或<)
(4)若△H<O,对已达到平衡的该混合物若只升温一段时间(其他条件不变),其中D的物质的量变化趋势是_________(填序号)
①增人 ②减小 ⑧不变 ④以上三种都有可能
作出此判断的理由是__________________________。 28.(12分) 有a、b两个恒温密闭容器,a保持容积不变,b中的活塞可上下移动以保持内外压强相等。在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生如下反应:3A(g) + B(g)![]() 2C(g)
+ D(g)
2C(g)
+ D(g)
⑴ 达平衡时a中A的浓度是Mmol/L,C的浓度是Nmol/L,b中A的浓度是m mol/L,C的浓度是n mol/L,试比较N与n的大小(选填:>或<或=):N n
⑵ 选择下列配比分别充入a、b两容器中,达平衡后a中C的浓度仍为Nmol/L的是 ,b中的C浓度仍为n mol/L的是 。
① 6molA + 2molB ② 3molA + 2molC
③ 2molC + 1molB + 1molD ④ 1.5molA + 0.5molB + 1molC + 0.5molD
⑶ 若将2molC和2molD充入a中,平衡时A的浓度为X mol·L-1,C的浓度为Y mol/L,则X与M,Y与N之间关系为:X M,Y N(选填:>或<或 =)
⑷ 若将4molC和2molD充入a中,平衡时A的浓度为R mol/L。则
① R=2M ② R<M ③ M<R<2M ④ R>2M
29.(10分)
Ⅰ.(2分) 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
Ⅱ.(8分) 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
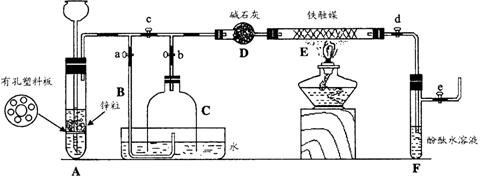
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
⑴ 检验氢气纯度的目的是 。
⑵ C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是
。
C瓶内气体的成份是 。
⑶ 在步骤③中,先加热铁触媒的原因是 。
反应管E中发生反应的化学方程式是 。
四、计算题(本题8分)
![]() 30.滴定度是指每毫升标准溶液相当于被测定物质的克数,通常是用T(M1/M2)表示。如T(H2SO4/
NaOH) 0.040g/mL,表示每毫升标准H2SO4溶液恰好中和0.040gNaOH。
30.滴定度是指每毫升标准溶液相当于被测定物质的克数,通常是用T(M1/M2)表示。如T(H2SO4/
NaOH) 0.040g/mL,表示每毫升标准H2SO4溶液恰好中和0.040gNaOH。
⑴若要使某标准盐酸对氧化钙的滴定度为T(HCl/CaO)=0.0056g·mL-1,则该盐酸物质的量浓度是多少?
⑵上述盐酸对NaOH 的滴定度是多少?
⑶ 现欲测定含有杂质的NaOH 样品的纯度(杂质不与盐酸反应),若用上述盐酸滴定到终点时,消耗盐酸的体积数恰好等于该NaOH 的纯度(如消耗1mL盐酸,NaOH 的纯度为1%),则样品的质量应取多少?
化学试题答题卷
一、选择题:(共50分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 | |||||||||||||
| 题 号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答 案 |
第Ⅱ卷(共50分)
二、填空题(本题共4小题,共42分)
26.(6分)
⑴ (2分) 。
⑵(2分)H2CO3、HCO3-、HA、HB的电离程度由大到小顺序 。
⑶(2分)[c(CN-)+c(OH-)] ______ [c(F-) + c(OH-)](填“等于”、“大于”或“小于”)。
27.(14分)(1)D的化学反应速率为_______mol/(L·min);B的转化率为_________;
(2)变化趋势是_______(填序号) 作出此判断的理由是______________________。
________________________________________________________________________
(3)则△H____0:(填>、=或<)
(4)D的物质的量变化趋势是_________(填序号)
作出此判断的理由是_________________________________________________________ ________________________________________________________________ 28.(12分) ⑴ N n
⑵ 仍为Nmol/L的是 ,仍为n mol/L的是 。
⑶X M,Y N(选填:>或<或 =)
⑷则
29.(10分)
Ⅰ.(2分) 实验室制备氨气,下列方法中适宜选用的是 。 Ⅱ.(8分)⑴ 检验氢气纯度的目是 。
⑵ A装置内发生的现象是 ,打开弹簧夹b的原因是
C瓶内气体的成份是 。
⑶ 在步骤③中,先加热铁触媒的原因是 。
反应管E中发生反应的化学方程式是 。
四、计算题(本题8分)
30.
化学试题参考答案
一、选择题:(共50分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 | C | B | C | D | D | B | A | A | B | B | D | B | D |
| 题 号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答 案 | D | B | D | C | A | D | B | C | D | D | C | D |
第Ⅱ卷(共50分)
二、填空题(本题共4小题,共42分)
26.(6分)
⑴ 1 , 12.4 或 (13-lg4)
⑵ H2CO3>HB>HCO3->HA;
⑶小于。
27.(14分)27.(1)0.012/V 60% (2)④理由:平衡正向运动时,气体总质量减少,气体总物质的量也减少,则汪能确定平均分子量的变化。
(3)>(4)②理由:△H<0说明正反应放热反应,则升高温度,平衡逆向移动,则D物质的量减少。
28.(12分) ⑴ N < n
⑵ 仍为Nmol/L的是 4 ,仍为n mol/L的是 1、4 。
⑶X > M,Y < N(选填:>或<或 =)
⑷则 3
29.(10分)Ⅰ.②④
Ⅱ.⑴ 排除空气,保证安全
⑵ 锌粒与酸脱离 尽量增大氢气的浓度以提高氮气的转化率 N2 H2
⑶ 铁触媒在较高温度时活性增大,加快氨合成的反应速率
N2+3H2\s\up8(铁触媒铁触媒△2NH3
四、计算题(本题8分)
30.⑴ 0.20 mol·L-1 ⑵ 0.0080 g·mL-1 ⑶ 0.80 g