高二年级化学第一学期期中考试试题
可能用到的相对原子质量:N 14 H 1 Cu 64 O 16
一、选择题(每题有1个正确答案,每题2分,共40分)
1.下列物质中有剧毒的是 ( )
(A)红磷 (B)白磷 (C)氮气 (D)二氧化碳
2.常温下最难与浓硝酸发生持续反应的是 ( )
(A)Al (B)Mg (C)Cu (D)Zn
3.下列试剂保存方法正确的是 ( )
(A)浓HNO3放在棕色瓶中 (B)白磷放在煤油中
(C)氢氟酸保存在玻璃瓶中 (D)钠放在冷水中
4.既能用浓H2SO4干燥,又能用P2O5干燥的气体是 ( )
(A)HI (B)SO2 (C)NH3 (D)H2S
5.下列各组物质互为同素异形体的是 ( )
(A)红磷与白磷 (B)磷酸与偏磷酸
(C)NO2与N2O4 (D)![]() Cl和
Cl和![]() Cl
Cl
6.可逆反应达到平衡的重要特征是 ( )
(A)正逆反应速率相等反应正在进行 (B) 正逆反应速率均为零
(C)正逆反应都还在继续进行 (D)反应停止了
7.对于某一可逆反应来说,使用催化剂的作用是 ( )
(A)提高反应物的平衡转化率 (B)增大正反应速率,减小逆反应速率
(C)同等程度地改变正逆反应的速率 (D)改变平衡混合物的组成
8.反应A(g)+3B(g)![]() 2C(g)+Q(
放热
)达平衡后,将气体混合物的温度降低,
2C(g)+Q(
放热
)达平衡后,将气体混合物的温度降低,
下列叙述正确的是 ( )
(A)正反应速率加大,逆反应速率减小,平衡正向移动
(B)正反应速率减小,逆反应速率加大,平衡逆向移动
(C) 正反应速率和逆反应速率都减小,平衡正向移动
(D)正反应速率和逆反应速率都减小,平衡逆向移动
9.在氨氧化法制硝酸中的尾气,造成环境污染的主要物质是 ( )
(A)HNO3与NO (B)NO2与H2S (C)H2与NO (D)NO与NO2
10.下列关于浓HNO3与浓H2SO4的叙述正确的是 ( )
(A)常温下都可用铁制容器贮存 (B)常温下都能与铜较快反应
(C)露置于空气中,溶液质量均减轻 (D)露置于空气中,溶液浓度均增大
11.检验某稀溶液中是否会有NO3![]() 时,下列方法正确的是 ( )
时,下列方法正确的是 ( )
(A)加浓H2SO4与Cu片后共热 (B)加热蒸干后再加浓硫酸与铜片
(C)加热浓缩后与浓硫酸、铜片共热 (D)加入NaOH溶液,加热
12.制取相同质量的Cu(NO3)2时,消耗硝酸质量最多的是 ( )
(A)铜与浓HNO3反应 (B)铜与稀硝酸反应
(C)氧化铜与硝酸反应 (D)氢氧化铜与硝酸反应
13.有一处于平衡状态的反应:X(g)+3Y(g) ![]() 2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
( )
2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
( )
①高温
②低温
③高压
④低压 ⑤加催化剂 ⑥除去Z
(A)①④⑥ (B)②③⑤ (C)①③⑥ (D)②③⑥
14、下列事实不能用勒夏特利原理来解释的是 ( )
(A)光照新制的氯水时,溶液中的氢离子浓度逐渐增大
(B)加催化剂使N2和H2在一定条件下转化为NH3
(C)增大压强,有利于SO2和O2反应生成SO3
(D)在Fe3++3KSCN![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
15.对于可逆反应A(气)+2B(气) ![]() 2C(气)(正反应放热) 的平衡体系,下列说法错误的是
2C(气)(正反应放热) 的平衡体系,下列说法错误的是
(A)使用催化剂,v正、v逆都改变,变化的倍数相同
(B)降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
(C)增大压强,正、逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数
(D)升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数
16.NO与NO2的混合气体60ml,通入水中,最后收集到的气体体积为40ml(气体体积均在相同条件下测定),则原混合气体中NO与NO2的体积比为 ( )
(A) 1∶2 (B) 2∶3 (C) 3∶2 (D)1∶1
17.在图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大。则气体X与液
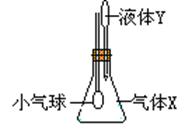 体Y不可能是 ( )
体Y不可能是 ( )
|
| A | B | C | D |
| 气体X | NH3 | SO2 | CO2 | HCl |
| 液体Y | 水 | 浓NaOH | 稀H2SO4 | 称食盐水 |
18.同主族的元素所形成的同一类型化合物,其结构与性质往往相似,化合物PH4I是一种无色晶体,下列对它的叙述中,正确的是 ( )
(A)它是一种共价化合物 (B)在加热条件下该化合物不分解
(C)这种化合物不能与碱反应 (D)该化合物可以由PH3与HI化合生成
19.在密闭容器中进行下列反应:
M(气)+N(气) ![]() R(气)+2L,此反应符合右面图像,下列
R(气)+2L,此反应符合右面图像,下列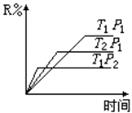 叙述正确的是
叙述正确的是
(A) 正反应吸热,L是气体
(B) 正反应吸热,L是固体
(C)
正反应放热,L是气体
(D) 正反应放热,L是固体或液体
20、在密闭容器中进行如下反应:X2(气) + Y2(气) ![]() 2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
( )
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
( )
(A)Z 为 0.3 mol/L (B) Y2 为 0.35 mol/L
(C) X2 为 0.2 mol/L (D) Z 为 0.4 mol/L
二、填空题(共30 分)
21.可逆反应:![]()
![]()
![]() 当采取下列措施时,对正、逆反应速率的影响是(填增大或减小或不变,共6分):
当采取下列措施时,对正、逆反应速率的影响是(填增大或减小或不变,共6分):
(1)增大 ![]() 的浓度,正反应速率
的浓度,正反应速率
(2)减小 ![]() 的浓度,正反应速率
的浓度,正反应速率
(3)增大反应容器的压强,正反应速率 ,逆反应速率 ;
(4)升高温度,正反应速率 ,逆反应速率 。
22.配平下列化学(或离子)方程式:(6分)
(1) ____Cu2S+ ____HNO3 == ___Cu(NO3)2+ __NO+ __H2SO4+ __H2O
(2) __SO3![]() + __MnO4
+ __MnO4![]() + __H
+ __H![]() == __Mn
== __Mn![]() + __SO4
+ __SO4![]() + __H2O
+ __H2O
23.(共5分)实验室通常制氨的化学反应方程式是____________________________________。可用____________干燥制取的氨。用__________________法收集NH3,用_________________________检验NH3是否充满。
![]() 24.(共5分) 2A B+2C在某一温度时,达到平衡。
24.(共5分) 2A B+2C在某一温度时,达到平衡。
(1) 若温度升高,平衡向正反应方向移动,则正反应是______热反应;
(2) 若B固体,降低压强时,平衡向逆反应方向移动,则A不会是_______态;
(3) 若A是气态时,加压时,平衡不移动,则B为______态,C为_____态。
25.根据化学方程式:![]()
![]()
![]() 反应起始
反应起始
![]() 皆为O,
皆为O, ![]() ,
,
![]() 后
后
![]() ,求:
,求:
(1) ![]() 时
时
![]() 为 ;
为 ;
(2) ![]() 时
时
![]() 为 ;
为 ;
(3) ![]() 内
内
![]() 平均反应速率为 ;
平均反应速率为 ;
(4) ![]() 内
内
![]() 平均反应速率为
。
平均反应速率为
。
三、实验题(14分)
26.某种常见的白色晶体A与盐酸反应,产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加浓Ba(OH)2溶液,则产生白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A可生成水、B和D,而且B与D的物质的量之比为1∶1,据此判断,A 、B、C、D分别是什么物质?并写出有关化学方程式。
A:___________ B:_______ C:____________ D:_________
_____________________________ ________________________________
_____________________________ _________________________________
_____________________________ ________________________________
四、简答题(共6分)
27.在一定温度,一定压强下,合成氨的反应,从反应开始至 ![]() 的浓度不再增大,这一过程中正反应速率如何变化?逆反应速率如何变化?为什么?简述理由。
的浓度不再增大,这一过程中正反应速率如何变化?逆反应速率如何变化?为什么?简述理由。
![]() 28.(3分)牙齿表面受到一层硬的、组成为Ca5(PO4)3OH的物质的保护,它在唾液中存在下列平衡:Ca5(PO4)3OH 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是
28.(3分)牙齿表面受到一层硬的、组成为Ca5(PO4)3OH的物质的保护,它在唾液中存在下列平衡:Ca5(PO4)3OH 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
五、计算题(10分)
29.38.4mg铜与适量的浓硝酸反应,铜全部作用后,共收集到气体22.4ml(标况),反应中所消耗的HNO3的物质的量是多少?(不考虑反应2NO2 ![]() N2O4)
N2O4)
30、在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2![]() 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:[NO2]=0.06mol/L,[NO]=0.24mol/L。
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:[NO2]=0.06mol/L,[NO]=0.24mol/L。
试求①NO2的转化率 ②反应前后的压强比为多少
高二年级化学答案
一、选择题(每题2分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | A | B | A | A | C | C | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | A | D | B | B | D | C | D | C | B |
二、填空题(共30分)
21.(1)增大 (2)减小 (3)增大,增大 (4)增大,增大
22.(1) 3Cu2S+ 22HNO3 == 6Cu(NO3)2+ 10NO+ 3H2SO4+ 8H2O
(2) 5SO3![]() + 2MnO4
+ 2MnO4![]() + 6H
+ 6H![]() ==
2Mn
==
2Mn![]() + 5SO4
+ 5SO4![]() + 3H2O
+ 3H2O
23.实验室通常制氨的化学反应方程式是Ca(OH)2+2NH4Cl=CaCl2+2NH3+2H2O 。可用_碱石灰干燥制取的氨。用_向下排空气法法收集NH3,用湿润的红色石蕊试纸检验NH3是否充满。
24.(1)吸热, (2) 固态或液态,
(3)固态或液态, 气态
25.(1) ![]() (2)
(2) ![]() (3)
(3) ![]()
(4) ![]()
三、实验题(14分)
26.31.A:碳酸氢氨 B:二氧化碳 C:碳酸钡 D:氨气
化学方程式:略(共5 个)
四、简答题(共6分)
27.正反应速率不断减小,因为反应中随 ![]() 、
、
![]() 消耗反应物浓度不断减小。逆反应速率不断增大,因反应中
消耗反应物浓度不断减小。逆反应速率不断增大,因反应中
![]() 浓度不断增大。
浓度不断增大。
注意:以上变化,达到一定程度, ![]() ,反应速率将不再变化。
,反应速率将不再变化。
28.氢离子中和了氢氧根离子,化学平衡向正反应方向移动。
五、计算题(8分)
29. ![]()
30.80%, 10:14![]()