高二年级化学第一次月考试卷
化 学 试 卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间为90分钟。
注意事项:
1.各题的答案和解答过程均写在答题纸的指定处,写在试卷上无效。
2.考试前考生务必将自己的“班级”、“序号”和“姓名”写在答题纸相应的位置上。
3.可能用到的相对原子质量:H-1 N-14 O-16 Cu-64
第Ⅰ卷(选择题 共50分)
一、选择题(每小题只有一个选项符合题意,每题2分,共50分)
1、下列气体中,不会造成空气污染的是 ( )
A、N2 B、NO C、NO2 D、CO
2、通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是 ( )
A、NH3 B、Cl2 C、NO D、HCl
3、下列气体的制取中,与氨气的实验室制取装置相同的是 ( )
A.CO2 B.H2 C.Cl2 D.O2
4、6.4g铜放入400ml浓度为0.5mol/L的硝酸中,充分反应后,被还原的HNO3的量为 ( )
A、0.03mo l B、0.05mol C、0.1mol D、0.2mol
5.生物固氮是指( )
A 生物从土壤中吸收含氮养料
B 豆科植物根瘤菌将含氮化合物转变为植物蛋白质
C 将氨转变成硝酸及其它氮的化合物
D 生物将空气中的氮气转变成含氮化合物
6、使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是
![]()
![]() A.Cu+HNO3(稀) B.Cu CuO
Cu(NO3)2
A.Cu+HNO3(稀) B.Cu CuO
Cu(NO3)2
![]()
![]() C.Cu+HNO3(浓)
D.Cu CuCl2 Cu(NO3)2
C.Cu+HNO3(浓)
D.Cu CuCl2 Cu(NO3)2
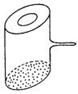 7、实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是
7、实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是
A.NH4Cl受热分解的实验 B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验 D.无水CuSO4与胆矾的互变实验
8、 关于磷的下列叙述中,正确的是( )
A、红磷没有毒性而白磷剧毒
B、白磷在空气中加热到260℃可转变为红磷
C、白磷可用于制造安全火柴
D、少量白磷应该保存在煤油中
9、木炭屑与浓HNO3共热,产生的气体等分为①和②两份,将第一份气体先导入适量蒸馏水中再导入石灰水中,将第二份气体直接导入石灰水中,则石灰水的变化可能是
A.①不变浑浊②变乳白色 B.①变乳白色②不变浑浊
C.①变乳白色②变乳白色 D.①不变浑浊②变浅黄色
10、下列说法中不正确的是 ( )
A、NO中有少量的NO2:用水洗涤后再干燥
B、白磷应保存在水中,切割白磷应在水下进行。
C、N2中有少量的O2:通过灼热的铜网
D、红磷中有少量的白磷:加热到40℃,使白磷自燃
11、氨水中存在的粒子有( )
①NH3 ②NH3•H2O ③H2O ④OH- ⑤NH4+ ⑥H+
A.①②③④ B.②④⑤⑥ C.①②③④⑤ D.①②③④⑤⑥
12、取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加65%的HNO3、98.3%的H2SO4和新制的氯水,三张试纸最后依次呈现的颜色是( )
 A.白、红、白 B.红、黑、红 C.红、红、红 D.白、黑、白
A.白、红、白 B.红、黑、红 C.红、红、红 D.白、黑、白
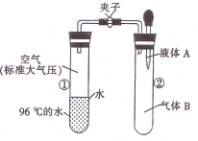
13、如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
14.可逆反应达到平衡的根本原因是 ( )
A.反应混合物中各组分的浓度相等 B.正逆反应都还在继续进行
C.正逆反应的速率均为零 D.正逆反应的速率相等
15.对某一可逆反应来说,使用催化剂的作用是 ( )
A.提高反应物的平衡转化率 B.以同样程度改变正逆反应的速率
C.增大正反应速度,减小逆反应速率 D.改变平衡混合物的组成
16.可逆反应:A+3B![]() 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是 ( )
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是 ( )
A.u D=0.4 mol / (L·s) B.u C=0.5 mol / (L·s)
C.u B=0.6 mol / (L·s)
D.![]() A=0.15 mol / (L·s)
A=0.15 mol / (L·s)
17.对已达平衡的可逆反应2X(g)+Y(g)![]() 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
18.下列物质的保存、分离、提纯和鉴别的方法中(必要时可加热),可行的是 ( )
A.以AgNO3溶液和稀盐酸检验某溶液中是否含有Cl-
B.用升华法分离碘和氯化铵的混合物
C.用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+
D.将NaOH溶液保存在带有磨口玻璃塞的试剂瓶中
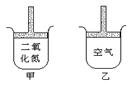 19.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,使两容器体积相等,现分别进行下列两个实验:①将两容器都置于沸水中加热;②在活塞上都加2 kg的砝码;在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
19.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,使两容器体积相等,现分别进行下列两个实验:①将两容器都置于沸水中加热;②在活塞上都加2 kg的砝码;在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
A.①甲>乙 ②甲>乙
B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙
D.①甲>乙 ②甲=乙翰林汇
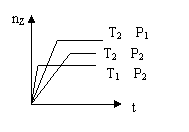 20.反应2X(g)+Y(g)
20.反应2X(g)+Y(g)![]() 2Z(g),在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
2Z(g),在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
A.T1<T2,P1<P2,正反应吸热 B.T1<T2,P1>P2,正反应放热
C.T1>T2,P1>P2,正反应放热 D.T1>T2,P1<P2,正反应吸热
|
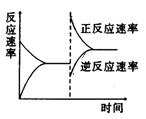 21.右图是关于反应A2(g)+3B2(g)
21.右图是关于反应A2(g)+3B2(g)![]() 2C(g)(正反应为放热反应)
2C(g)(正反应为放热反应)
的平衡移动图象,影响平衡移动的原因可能是 ( )
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用催化剂;
D.增大反应物浓度,同时减小生成物浓度
22. 下列反应中HNO3既表现出酸性又表现出强氧化性的是 ( )
A.Fe2O3+HNO3 B.Ca(OH)2+HNO3
C.P+HNO3 D.FeO+HNO3
23.某温度下H2(g)+I2(g) ![]() 2HI(g)在密闭容器中达到平衡,缩小容积,增大压强时,下列说法正确的是 ( )
2HI(g)在密闭容器中达到平衡,缩小容积,增大压强时,下列说法正确的是 ( )
A.容器内HI的产率增大 B.平衡正向移动
C.容器内气体颜色加深 D.容器内H2的质量分数增大
24.一定条件下,可逆反应NO2+CO![]() NO+CO2在容积不变的密闭容器中进行,当下列物理量不再随时间变化时,能说明该反应已达到平衡状态,该选项是 ( )
NO+CO2在容积不变的密闭容器中进行,当下列物理量不再随时间变化时,能说明该反应已达到平衡状态,该选项是 ( )
A.混合气体的压强
B.NO2的消耗速率与NO的生成速率之比
C.混合气体的颜色
D.混合气体的平均摩尔质量
25.某恒温恒容容器中,建立如下平衡:2A(g)![]() B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡( )
B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡( )
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
第Ⅱ卷(非选择题 共50分)
二.填空题:(本题包括5小题,共26分)
26.(6分)氨气电子式为 ,结构式为 ,实验室常用的制备方程式 。
27.(2分)配平:
SO32- + MnO4- + H+ — Mn2+ + SO42- + H2O
28.(6分)已知某非金属单质A,在常温下很稳定,一定条件下A与氢气能化合成B,能使湿润的红色石蕊试纸变蓝色,B与氧气在一定条件下能生成C,C在空气中能自然氧化生成红棕色气体D,D溶于水生成E和C,E与B化合又生成F,F既是化肥也能用作炸药,A,B,C,D均为气体。
(1)A,B,C,D,E,F的化学式分别为:
A B C D E F
29.(6分)反应2A ![]() B + C在某温度下达到平衡时:
B + C在某温度下达到平衡时:
(1)若温度升高,平衡向正反应方向移动,则此反应的正反应为_______反应。
(2)如果B是固体,在降低平衡体系的压强时,平衡向逆反应方向移动,则A是___态。
(3)如果已知A是气态,增加平衡体系的压强时,平衡不发生移动,则B是____________态,C是____________态。
(4)如果A与C均为气态,在体系中增加或减少B的量,平衡不发生移动,则B是
_ __态或_________态。
30.(6分)可逆反应A(g)+2B(g) ![]() 2C(g)(正反应为放热反应)在一定条件下达到平衡,若改变条件,将变化结果(填增大、减小、不变),填入空格。
2C(g)(正反应为放热反应)在一定条件下达到平衡,若改变条件,将变化结果(填增大、减小、不变),填入空格。
(1)升高温度,B的转化率 ,v正 。
(2)保持温度和压强不变,加入稀有气体,则C的物质的量 。
(3)保持温度和体积不变,再加入稀有气体,A的转化率 。
(4)若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,容器内气体的密度 ,平均相对分子质量 。
三、实验题(本题包括2小题,共10分)
31.(2分)将二氧化氮和四氧化二氮的混合气体装入端口封闭的注射器中,向内迅速推动活塞后保持体积不变,一段时间,观察到的颜色变化是_____________________。
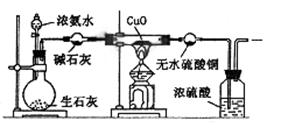
32.(8分)某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答:
|
(1)实验前先将仪器按图连接好,然后 ,再开始实验。
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成 色,盛无水CuSO4的干燥管内出现 色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质试管中的反应方程式为 ,这个反应说明氨气具有 性。
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是 。
(4)洗气瓶中浓硫酸的作用是吸水和 。
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是 (填编号)
A.排气法
B.排水法
C.用塑料袋或球胆收集
四.计算题:(本题包括3小题,共14分)
33.(4分)在温度为T℃,压强为PkPa时,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压,发生反应A(g)+B(g)![]() C(g)达到平衡时,C的体积分数为20%,试回答:
C(g)达到平衡时,C的体积分数为20%,试回答:
(1)上述反应达平衡时,容器的容积为 L。
(2)若温度和压强在上述条件下恒定不变,在密闭容器中充入2molA和2molB,反应达到平衡时,C的体积分数为 。
34、(4分)把盛有48mlNO和NO2混合气体的容器倒置于水中(保持同温同压),液面稳定后,容器内气体的体积变为24mL,则:
(1)原混合气中,NO2是 mL,
(2)若在剩余的24mL中,通入 mL O2再倒置于水中,气体会全部被吸收。
35. (6分) 1.92克Cu与100ml 1.0mol/L的稀硝酸充分反应。如果液体体积变化忽略不计,计算在标准状况下生成NO多少升;反应后溶液中NO3- 的浓度是多少?(写出计算过程)
化 学 答 卷
序号 班级 姓名
一、选择题(每小题只有一个选项符合题意,每题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 74 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二、填空题(本题包括5小题,共26分)
26.(6分)
电子式为 ,结构式为 ,
方程式 。
27.(2分)配平:
SO32- + MnO4- + H+ — Mn2+ + SO42- + H2O
28.(6分)化学式分别为:
A B C D E F
29.(6分)
(1)_______反应。
(2)A是_ __态。
(3)B是____________态,C是____________态。
(4)B是_ __态或_________态。
30.(6分)
(1)B的转化率 ,v正 。
(2)C的物质的量 。
(3)A的转化率 。
(4)气体的密度 ,平均相对分子质量 。
三、实验题(本题包括2小题,共10分)
31.(2分)
颜色变化是_____________________。
32.(8分)
(1)然后 ,
(2) 色, 色,
反应方程式为 ,氨气具
有 性。
(3)原因是 。
(4)吸水和 。
(5)收集方法是 (填编号)
四.计算题:(本题包括3小题,共14分)
33.(4分)
(1)容积为 L。
(2)C的体积分数为 。
34、(4分)
(1)NO2是 mL,
(2)通入 mL O2
35. (6分) (写出计算过程)
化 学 参考答案
三、选择题(每小题只有一个选项符合题意,每题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 74 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | A | C | D | B | D | B | B | A | B | D | D | D | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | D | B | B | C | C | B | C | D | D | C | C | B |
四、填空题(本题包括5小题,共26分)
26.(6分)
答案: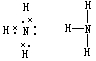
![]()
27.(2分)配平:
5 SO32- + 2 MnO4- + 6 H+ = 2 Mn2+ + 5 SO42- + 3 H2O
28.(6分)化学式分别为:
A N2 B NH3 C NO D NO2 E HNO3 F NH4NO3
29.(6分)
(1)吸热 反应。
(2)A是 气 态。
(3)B是 气 态,C是__气__态。
(4)B是_固__态或__液__态。
30.(6分)
(1)B的转化率 减小 ,v正 增大 。
(2)C的物质的量 减小 。
(3)A的转化率 不变 。
(4)气体的密度 不变 ,平均相对分子质量 增大 。
三、实验题(本题包括2小题,共10分)
31.(2分)
颜色变化是_气体颜色先变深,后变浅,但比原平衡时颜色深_。
32.(8分)
(1)然后 检查装置的气密性 ,
(2) 光亮红 色, 蓝 色,
反应方程式为 3CuO+2NH3![]() 3Cu+3H2O+N2
,氨气具有
还原 性。
3Cu+3H2O+N2
,氨气具有
还原 性。
(3)原因是 生石灰与水反应并放热促使氨气逸出 。
(4)吸水和 吸收多余氨气,保护环境 。
(5)收集方法是 C (填编号)
四.计算题:(本题包括3小题,共14分)
33.(4分)
(1)容积为 5/6V L。
(2)C的体积分数为 20% 。
34、(4分)
(1)NO2是 36 mL,
(2)通入18 mL O2
35. (6分) (写出计算过程)
0.448L,
0.8mol/L