高二理科化学上学期测试试卷
学校_______ 班级_________ 姓名________ 学号________
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Al—27 Fe—56 Cu—64 Zn—65
说明:1.本卷总分为100分,考试时间为100分钟。
2.第Ⅰ卷选择题的答案请填在第5页答案表中。
第Ⅰ卷(选择题 共40分)
一、每小题只有一个选项符合题意(1 ~ 20小题,每小题2分)
1.下列气体属于大气污染物的是
A.CO2 B.NO2 C.N2 D.H2
2.常温下,下列溶液可以用铝制器皿盛放的是
A.浓盐酸 B.氢氧化钠 C.浓硝酸 D.硫酸铜
3.下列金属通常采用热还原法冶炼的是
A.银 B.铝 C.钠 D.铁
4.下列物质中,导电能力最弱的是
A.熔融态氢氧化钠 B.固态氯化钾
C.醋酸溶液 D.石墨棒
5.下列各组物质中,都是极性分子的一组是
A.NH3 H2O B.CO2 HCl
C.NO H2 D.CH4 Br2
6.下列物质中,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是
A.NH4NO3 B.AlCl3 C.Na2CO3 D.Al2O3
7.对如下反应:CO(气)+ 2H2(气)![]() CH3OH(气)(正反应为放热反应),为提高单位时间内CH3OH的产量,工厂应控制的反应条件是
CH3OH(气)(正反应为放热反应),为提高单位时间内CH3OH的产量,工厂应控制的反应条件是
A.高温、低压 B.适宜的温度、高压、催化剂
 C.低温、低压 D.低温、高压、催化剂
C.低温、低压 D.低温、高压、催化剂
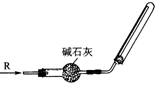
8.实验室可用右图所示的装置干燥、收集某气体R,
则R可能是
A.SO2 B.NH3 C.CO2 D.Cl2
9.向纯水中加入少量NaHSO4固体,当温度不变时,则该溶液中
A.水电离出的c(H+) 减小 B.c(OH-) 与 c(H+) 的乘积增大
C.c(H+ ) 减小 D.c(OH-) 增大
10.下列物质前者是强电解质、后者是弱电解质的是
A.KNO3 CH3COOH B.HCl NaHSO4
C.NaCl BaSO4 D.NH3·H2O H2SO4
11.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e- = Zn2+,2MnO2 + 2NH4++ 2e- = Mn2O3 + 2NH3 + H2O。
下列有关锌-锰干电池的叙述中,正确的是
A.干电池中锌筒为正极,石墨棒为负极
B.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
C.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
D.干电池可实现化学能与电能的相互转化
12.在密闭容器中发生可逆反应CO(气)+ H2O(气) ![]() CO2(气)+ H2(气)(正反应为放热反应),仅改变下列条件,不能使正反应速率增大的是
CO2(气)+ H2(气)(正反应为放热反应),仅改变下列条件,不能使正反应速率增大的是
A.升高温度
B.增大密闭容器的容积
C.使用催化剂 D.增大压强
13.一定温度下,反应A2(气)+ B2(气)![]() 2AB(气)达到化学平衡状态的标志是
2AB(气)达到化学平衡状态的标志是
A.单位时间生成 n mol 的 A2 ,同时生成 n mol 的 AB
B.容器内的总压强不随时间的变化而变化
C.单位时间生成2n mol 的 AB ,同时生成n mol 的 B2
D.单位时间生成n mol 的 A2 ,同时生成n mol 的 B2
14.下列实验方法能够实现的是
A.用10 mL 量筒量取 7.50 mL 稀盐酸
B.用托盘天平称取 25.20 g NaCl晶体
C.用广范 pH试纸测得某碱溶液的pH为12.7
D.用25 mL 碱式滴定管量取14.80 mL NaOH 溶液
15.下列离子方程式书写正确的是
A.铜和稀硝酸反应 Cu + 4H+ + NO3- = Cu2+ + 2H2O + NO↑
B.碳酸氢钠的水解
HCO3- + H2O
![]() CO32- + H3O+
CO32- + H3O+
C.Fe投入盐酸中 2Fe + 6H+ = 2Fe3+ + 3H2↑
D.氢氧化铝溶于氢氧化钠溶液 Al(OH)3 + OH- = AlO2- + 2H2O
16.下列事实不能用电化学理论解释的是
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐腐蚀
C.铝片不用特殊方法保存
D.锌跟稀硫酸反应时,滴入少量硫酸铜溶液后反应速率加快
17.只用一种试剂,将分别含有 Fe3+、Al3+、Mg2+、NH4+等阳离子的四种溶液区分开,这种试剂是
A.NaOH 溶液 B.NaCl 溶液 C.KSCN 溶液 D.氨水
18.体积相同、pH=3的HCl溶液和CH3COOH溶液分别跟足量的镁充分反应,则
A.HCl溶液产生较多的氢气 B.CH3COOH溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
19.在pH=1的溶液中,可以大量共存的离子组是
A.K+、Na+、SO42-、HCO3- B.Fe2+、Na+、SO42-、NO3-
C.Na+、K+、AlO2-、Cl- D.NH4+、Mg2+、SO42-、Cl-
20.一定量的硝酸与 3.2 g 铜充分反应,得到的还原产物有NO2和NO。反应后溶液中含有a mol H+,则此时溶液中含有NO3- 的物质的量是
A.a mol B.(a + 0.1)mol C.0.05 mol D.无法计算
高二化学(理科)试卷
学校_______ 班级_________ 姓名________ 学号________
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Al—27 Fe—56 Cu—64 Zn—65
选择题答案表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(非选择题 共60分)
二、(21 ~ 25小题,共29分)
21.(2分)常温下,pH = 4 的盐酸与 pH = 10 的氢氧化钠溶液等体积混合后,
溶液的 pH = (体积变化忽略不计)。
22.(6分)若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池。试回答:
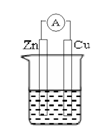 (1)Zn板作电池的 极,发生 反应。
(1)Zn板作电池的 极,发生 反应。
Cu板上的电极反应式: 。
![]() (2)经过一段时间后,电解质溶液的质量 (填“变大”或“变小”)。
(2)经过一段时间后,电解质溶液的质量 (填“变大”或“变小”)。
(3)若负极质量减轻1.3 g ,则正极生成 mol气体。
23.(4分)配平下列化学方程式:
KI + H2SO4(浓)= K2SO4 + SO2↑ + I2 + H2O
如反应生成1 mol I2,则电子转移的总物质的量为 mol,还原剂是 。
24.(9分)X、Y、Z是三种短周期元素,Z是自然界中原子半径最小的元素,单质
X2与Y2在放电条件下生成化合物A,X、Y、Z可以形成化合物ZXY3、XZ4XY3等。
试写出:
(1)元素X、Y、Z的元素符号分别为:X 、Y 、Z 。
(2)X2与Z2化合生成XZ3的化学方程式 。
(3)XZ3与Y2反应生成A的化学方程式 。
(4)在XZ4XY3的水溶液中,各离子浓度由大到小的顺序是 。
25.(8分)已知四种物质A、B、X、Y在一定条件下的转化关系如下图所示:
 |
(1)若A为第三周期金属元素的单质,不与NaOH溶液反应,B为黑色固态非金属
单质,该反应的化学方程式为 。
(2)若A为第三周期金属元素的单质,可与NaOH溶液反应,X是红棕色粉末,
请写出A与NaOH溶液反应的离子方程式 。
(3)若X在常温下为无色液体,Y是具有磁性的黑色晶体,B是气态非金属单质,则
A元素在周期表中的位置为第 周期第 族,该反应的化学方程式
为 。
![]() 三、(26 ~ 27小题,共21分)
三、(26 ~ 27小题,共21分)
26.(5分)某同学用标准浓度的盐酸滴定未知浓度的氢氧化钠溶液,以测定氢氧化钠
溶液的物质的量浓度。
(1)下列操作:①用标准液润洗酸式滴定管;②向酸式滴定管内注入标准液;③检查滴定管是否漏水;④滴定;⑤用水洗涤滴定管。正确的操作顺序是 。
(2)下列可能使所测氢氧化钠溶液的浓度偏低的操作是 。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.酸式滴定管在滴定前有气泡,滴定后气泡消失
C.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
D.滴定过程中,锥形瓶振荡过于剧烈,使少量溶液溅出
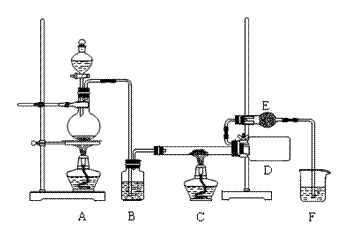 27.(16分)三氯化铁是一种高效、廉价的净水剂,它是红棕色固体,易潮解,100℃左右时升华。实验室可用氯气与铁反应制备无水三氯化铁,装置如图所示。试回答:
27.(16分)三氯化铁是一种高效、廉价的净水剂,它是红棕色固体,易潮解,100℃左右时升华。实验室可用氯气与铁反应制备无水三氯化铁,装置如图所示。试回答:
(1)装置B中的试剂是 ;装置E的作用是 。
(2)反应开始时应先点燃装置 处的酒精灯,过一会儿再点燃装置 处的酒精
灯,此操作的目的是 。
(3)欲用制得的FeCl3配制溶液,应先将装置D冷却后的固体粉末溶于
(填药品名称)中,再用水稀释到所需的浓度。结合离子方程式简要说明原因
。
简述检验Fe3+的方法 。
四、(28 ~ 29小题,共10分)
28.(5分)向含有 0.2 mol Fe3+ 的 500 mL 溶液中加入 0.2 mol Fe 粉,充分反应,试计算:所得溶液中 Fe2+ 的物质的量浓度(假设反应前后体积不变)。
29.(5分)炭粉和氧化铜的混合物共a g,在隔绝空气的条件下加热一段时间并冷却,固体质量变为 b g, 假设反应中炭粉全部转化为CO2,试计算:
(1)被还原的氧化铜的质量;
(2)b 的最小值。
高二化学(理科)试卷参考答案及评分标准
一、(1 ~ 20小题,每小题2分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | D | B | A | D | B | B | A | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | C | D | D | C | A | B | D | B |
二、(21 ~ 25小题,共29分)
21.(2分)7
22.(6分)(每空1分)
(1)负 氧化 2H+ + 2e- = H2↑ (2分)
(2)变大
(3)0.02
23.(4分)
2 KI + 2 H2SO4(浓)= 1 K2SO4 + 1 SO2↑ + 1 I2 + 2 H2O(2分)
2(1分) KI(1分)
24.(9分)
(1) N O H (每空1分)
|
|
|
![]() (3)4 NH3
+ 5O2 ==== 4NO + 6H2O
(2分)
(3)4 NH3
+ 5O2 ==== 4NO + 6H2O
(2分)
(4)c(NO3-) > c(NH4+) > c(H+) > c(OH-)(2分)
|
(1)2Mg + CO2 ==== 2MgO + C (2分)
(2)2Al + 2OH- + 2 H2O = 2AlO2- + 3H2↑(2分)
(3)四 Ⅷ (每空1分)
3Fe + 4 H2O(g) ==== Fe3O4 + 4H2↑(2分)
三、(26 ~27小题,共21分)
26.(5分)
(1)③⑤①②④ (3分)
(2)C 、D (2分,少一个答案得1分,有错不得分)
27.(16分)
(1)浓硫酸(2分) 防止水蒸气进入D装置 (2分)
(2)A(1分) C(1分) 赶尽装置中的空气(2分)
(3)盐酸(2分)若将FeCl3溶于水,Fe3+发生水解,Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+,出现浑浊现象,将FeCl3溶于一定量的盐酸中,抑制Fe3+水解,得到澄清溶液。(3分)取少量溶液于试管中,滴入几滴KSCN溶液,溶液变红,则证明原溶液中有Fe3+。(3分)(其它合理答案给分)
Fe(OH)3 + 3H+,出现浑浊现象,将FeCl3溶于一定量的盐酸中,抑制Fe3+水解,得到澄清溶液。(3分)取少量溶液于试管中,滴入几滴KSCN溶液,溶液变红,则证明原溶液中有Fe3+。(3分)(其它合理答案给分)
四、(28 ~ 29小题,共10分)
28.(5分)
解 2Fe3+ + Fe = 3Fe2+
2 1 3
0.2 mol 0.2 mol n(Fe2+) ----------------------------(1分)
![]() >
>![]() ∴ Fe 过量 ----------------------------(2分)
∴ Fe 过量 ----------------------------(2分)
![]() =
= ![]()
n(Fe2+) = 0.3 mol ---------------------------------------------------(1分)
c(Fe2+)
= ![]() =
= ![]() = 0.6
mol·L-1 ------------------(1分)
= 0.6
mol·L-1 ------------------(1分)
答:所得溶液中 Fe2+ 的物质的量浓度为 0.6 mol·L-1
29.(5分)
(1)![]() (2分)
(2分)
(2)![]() (3分)
(3分)