高二化学第二学期三科联赛试题
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Al—27 Fe—56 Cu----64
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意).
 1.下列化学用语表达正确的是
1.下列化学用语表达正确的是
A.S2—的结构示意图: B.乙炔的结构简式CHCH
![]()
![]() C NaCl的电子式 :
D.硝基苯的结构简式:
C NaCl的电子式 :
D.硝基苯的结构简式:
2、下列反应的离子方程式书写错误的是
A.氨水中通入少量二氧化硫 2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
B.次氯酸钙溶液中通入过量二氧化碳 Ca2+ +2ClO- +CO2 +H2O = CaCO3 ↓+ 2HClO
![]() C. 3mol的Cl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
C. 3mol的Cl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
D.苯酚钠溶液中通入CO2
3. 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10) 如下图,则下列判断错误的是
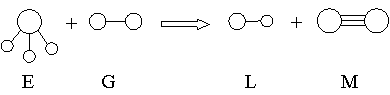
A、 M化学性质活泼 B、L是极性分子
C、E能使紫色石蕊试液变蓝色 D、G是最活泼的非金属单质
4.不饱和脂肪酸是常见的保健食品,DHA(分子式为C22H32O2)是近年来备受关注的一元不饱和高级脂肪酸(分子中只含有双键),它对大脑细胞的生长发育具有重要的意义,许多海洋生物食品含有丰富的DHA。则在一个DHA分子中含有的碳碳双键数为
A.4个 B.5个 C.6个 D.7个
5.在一定条件下,下列物质中既能与HCl反应,又能与NaOH作用的是
①NaHCO3 ②NH4HS ③Al(OH)3 ④AgNO3 ⑤Fe(NO3)2
⑥NH2CH2COOH ⑦CH3CH=CHCOOH
A.全部 B.除④⑤⑦外 C.除⑤⑦外 D.除⑦外
6.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A 酸性 B 碱性 C 氧化性 D 还原性
7. 某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
A.V(酸)=102V(碱) B. V(酸)=2V(碱)
C. V(碱)=102V(酸) D.V(碱)=2V(酸)
8.下列溶液中,有关离子一定能大量共存的是
A.能跟金属铝反应生成氢气的溶液中:NH4+、Al3+、Cl-、SO42-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变红色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.能使石蕊呈蓝色的溶液中: Na+、I-、Cl-、NO3-
9.NA表示阿伏加德罗常数,以下说法正确的是
A.28 g乙烯分子里含有共用电子对数目为6NA
B.在熔融状态下,1 mol NaHS04完全电离出的阳离子数目为2NA
C.7.8 g Na202含有的阴离子数目为0.2NA
D.22.4l氖气所含的原子数为2 NA
10.下列物质的除杂方法:其中合理的是①SO2中混有的SO3杂质可以让混合气体通过浓硫酸除去;②MnO2中混有的少量有机物,可以用加热的方法除去;③乙烯中混有的SO2气体可以通过溴水除去;④鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中⑤用稀HNO3清洗做过银镜反应实验的试管;
A.①②④⑤ B.①②③④ C.②③④⑤ D.①②③④⑤
11.在25℃时,浓度均为1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得其中c(NH4+)分别为 a、b、c(mol/L),则下列判断正确的是
A.a>b>c B.c>a>b C.b>a>c D.a>c>b
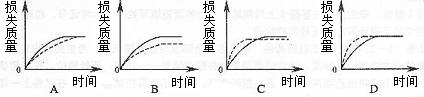
12.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g A粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
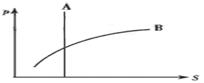 13.已知摩尔质量相等的化合物A和B,在25℃时,其溶解度(S)与压强(P)的关系如图所示,则在该温度下,同体积的A和B溶于等体积水(均形成溶液)后,c(A)与c(B)关系正确的是(A )
13.已知摩尔质量相等的化合物A和B,在25℃时,其溶解度(S)与压强(P)的关系如图所示,则在该温度下,同体积的A和B溶于等体积水(均形成溶液)后,c(A)与c(B)关系正确的是(A )
A、c(A)>c(B) B、c(A)<c(B)
C、c(A)=c(B) D、无法确定
14. 元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有
A. 能与水反应 B. 能与氢氧化钠反应
C. 能与硫酸反应 D. 能与碳酸钠反应
15.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶4 D.1∶2
![]() 16.下图中,P为一可自由滑动的活塞。关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA
= aL;VB = 0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X (g) + 3Y (g) 2Z (g) + 2W (g),达到平衡时,VB = 0.6aL。以下说法正确的是
16.下图中,P为一可自由滑动的活塞。关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA
= aL;VB = 0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X (g) + 3Y (g) 2Z (g) + 2W (g),达到平衡时,VB = 0.6aL。以下说法正确的是
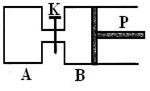 A. A、B两容器达到平衡的时间: tA小于tB
A. A、B两容器达到平衡的时间: tA小于tB
B.平衡时,B中Y的转化率为25%
C.当A、B分别达到平衡时,两容器中物质W的百分含量关系是:A大于B
D.打开K,一段时间后反应可再次达到平衡,则此时B的体积为0.2a L
二、填空题 (本题包括4小题,共52分)
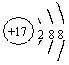
17.(14分)甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件下的相互转化关系如下:
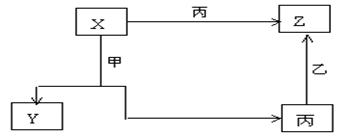
请填写以下空白:
1,在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是 。
2, 在X、Z两种化合物的正价元素的化合价中,是 。
A 前者高 B 后者高 C 不一定
原因是 。
3, 当X为两种非金属元素组成的化合物时
写出X跟甲反应的化学方程式 。
写出丙跟乙反应的化学方程式
4, 当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式 。写出丙跟乙反应的化学方程式 。
18.、Ⅰ。(4分) 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 将乙烯、乙炔分别通入溴水中,乙炔使溴水的褪色速度快
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
Ⅱ.(12分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
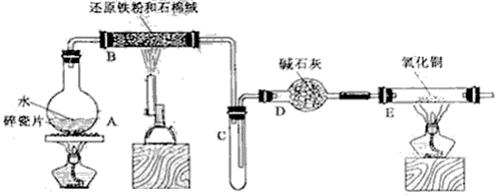
(1)装置B中发生反应的化学方程是 。
(2)装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液→FeCl3溶液→FeCl3·6H2O晶体
①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
19、(14分)0.2mol有机物A在氧气中完全燃烧后,生成79.2gCO2和18g水,同时消耗O247.04L(标准状况),A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):
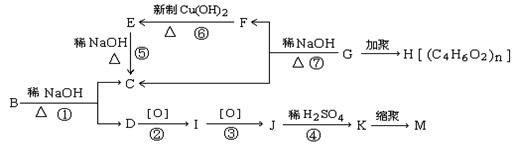
其中K与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。已知:
①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH—→RCHCHO。
② —ONa连在烃基上不被氧化。
请回答下列问题:
(1)写出结构简式:B:____________I:______________M:________________
(2)上述变化过程中,属于取代反应的是(填编号① ② ③……)______________
(3)写出下列反应的化学方程式(有机物用结构简式表示)。
①G—→F+C: ________________________________________________
②K与过量的Na2CO3溶液反应:__________________________________________
(4)同时符合下列要求的A的同分异构体有__________种。
①含有苯环 ②能发生银镜反应和水解反应
③在稀NaOH溶液中,1mol该同分异构体能与1molNaOH反应
20.铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式_______________________________;
(2)产物中硝酸铜的物质的量______________mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol;
(4)如混合物中Cu的物质的量为X,求X的取值范围________________。
高二化学化学试题参考答案及评分标准
一、单项选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.D 2.B 3.A 4.C 5.A 6.D 7.C 8.D 9.A 10.A 11.B 12.C 13.A 14 .B 15.C 16. D
二、填空题(本题包括4小题,共52分)
17 (14分)(每空均为2分)1 X、Z 2 C;与构成该化合物的元素是金属或非金属有关
3 CO2+2Mg![]() 2MgO+C; 2CO+O2=2CO2 4 2FeBr2+3Cl2=2FeCl3+2Br2;2Fe+3Br2=3FeCl3
2MgO+C; 2CO+O2=2CO2 4 2FeBr2+3Cl2=2FeCl3+2Br2;2Fe+3Br2=3FeCl3
18.Ⅰ。(4分)①
②⑤ ⑦ Ⅱ.(12分) ( 1)3Fe+4H2O(g) Fe3O4+4H2
(2)黑色固体变红,右端管壁有水珠
(3)取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
(4)①将Fe2+氧化成Fe3+ ②加热浓缩。冷却结晶,过滤
![]() ③3Fe3++3H2O Fe(OH)3+3H+,过量盐酸抑制FeCl3水解
③3Fe3++3H2O Fe(OH)3+3H+,过量盐酸抑制FeCl3水解
19.(14分,每空各2分)
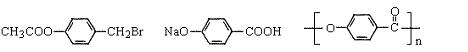
(1)
(2)①⑦
(3)①CH3COOCH=CH2+NaOH→CH3COONa+CH3CHO
②![]()
(4) 5
三、(本题8分)
20.(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
(2)0.025
(3)0.005 0.005
(4)0.005<x<0.015 (每空均为2分)
高二化学化学试题答题卷
一、选择题(本题包括16小题,每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、填空题 (本题包括4小题,共52分)
17.(1)--------- (2)------- --------------------------------------------
(3)---------------------------------------------------------------------
---------------------------------------------------------------------
(4)----------------------------------------------------------------------
---------------------------------------------------------------------
18 Ⅰ。------------ Ⅱ.(1)————————————————————
(2)———————————————————————————————
(3)------------------------------------------------------------
(4)① ————————————————————————————————
② ————————————————————————————————
③ ————————————————————————————————
19.(1)————————————— ——————————————
————————————— (2)——————————————
(3)① ——————————————————————————————
② ——————————————————————————————
(4)————————
20.(1)——————————————————————————————————
(2)—————————
(3)———————————— ——————————————
(4)————————————————————————————