高二年级上册期末考试化学模拟试题(二)
第Ⅰ卷(选择题)
一、选择题(每题只有一个正确选项,每题3分,共24分。)
1.已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是:
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,有部分AgCl转化为AgI,说明AgCl溶解度小于AgI
2.室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
3.从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:
HIn(溶液,红色)![]() H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为:
H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为:
A.红色变深 B.黄色变浅 C.黄色变深 D.褪为无色
4.向10mL pH=12的某碱溶液中加入10mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是:
A.弱碱 B.一元强碱 C.多元强碱 D.任何碱
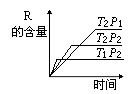 5.在密闭容器中进行下列反应:M(g)+N(g)
5.在密闭容器中进行下列反应:M(g)+N(g)![]() R(g)+2 L(?)此反应符合下面图像。下列叙述正确的是:
R(g)+2 L(?)此反应符合下面图像。下列叙述正确的是:
A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是液体 D.正反应放热,L是气体
6.下列关于铜电极的叙述正确的是:
A.铜一锌原电池中,铜是原电池的负极 B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用金属铜作阳极 D.电解稀硫酸制H2、O2时,铜作阳极
7.一种新型燃料电池,它多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,电极反应式:C2H6 +18OH—-14e—= 2CO32—+ 12H2O,7H2O+(7/2)O2+14e—=14OH-,有关此电池的推断正确的是:
A.电解质溶液中电子向正极移动 B.放电一段时间后,KOH的物质的量浓度不变
C.通乙烷的电极为负极 D.参加反应的O2和C2H6的物质的量之比为2:7
8.在一个容积为V L的密闭容器中放入2 L A(g)和1 L B(g),在一定条件下发生下列反应3A(g)十B(g)![]() nC(g)+2D(g)
达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g)
达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
A.1 B.2 C.3 D.4
二、选择题(每题有1—2个正确选项,每小题3分,共30分)
9.人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
![]()
![]()
![]()
![]() H++HCO3— H2CO3 CO2+H2O H++PO43- HPO42- H++HPO42- H2PO4-
H++HCO3— H2CO3 CO2+H2O H++PO43- HPO42- H++HPO42- H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是:
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如果CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小。
10.下列离子方程式书写正确的是:
A.碳酸钠溶于水:![]()
B.向![]() 粉末中加入足量HI溶液:
粉末中加入足量HI溶液:![]()
C.向![]() 溶液中加入过量盐酸:
溶液中加入过量盐酸:![]()
D.将Mg粉加入![]() 溶液中:
溶液中:![]()
11.经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法正确的是:
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液呈酸性,则一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若溶液呈碱性,则一定满足:c(NH4+)>c(Cl-)
D.若溶液呈中性,则一定满足:c(NH4+)>c(Cl-)
12.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.2c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
13.![]() 在一密闭容器中,反应mM(气) nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则
在一密闭容器中,反应mM(气) nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则
A.平衡逆向移动; B.物质M的转化率增大;
C.n > m D.物质N的质量分数减少
14.下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
A.②③⑤ B.①④⑦ C.②⑦⑨ D.⑧⑨⑩
15.在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)![]() 2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
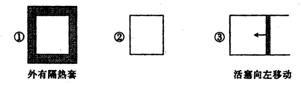
A. ③②① B.②①③ C.①②③ D.③①②
16.在常温下100mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7,则对反应后溶液的叙述正确的是
A.V(混合液)≥200mL B.V(混合液)≤200mL
C.c(H+)= c(OH-)< c(K+)< c(A-) D.c(A-)= c(K+)
17.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)> c(A-)> c(H+)> c(OH-)
18.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
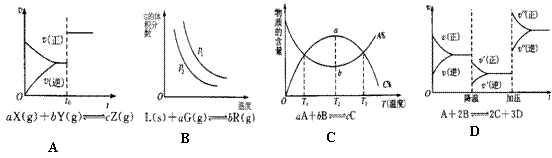
A.密闭容器中反应达到平衡,t0时改变某一条件有如图所示,则改变的条件一定是加入催化剂
B.反应达平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应
D.反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体
第Ⅱ卷(非选择题)
三、实验题:(本大题包括两小题,共12分)
19.(6分)实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为 mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为C2 mol/L。在下述情况下,C1与C2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则C1 C2。
②当Na2CO3中含有NaOH时,则C1 C2。
20.(6分)现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
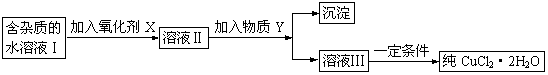
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________。
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)除去Fe3+的有关离子方程式是(物质Y在(2)中选择合适的选项):
(4)加入氧化剂的目的是________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)________________________________。
四、填空题(本大题包括四小题,共40分)
21.(12分)(1)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括 ,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合化学方程式简要说明) 。
(2)过氧化氢( H2O2)是一种无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。H2O2是一种二元弱酸,请写出它的第二步电离方程式 ,向H2O2溶液中加入过量Ba(OH)2溶液, 反应的化学方程式________________________。
(3)已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
①若该溶液中只含有一种溶质,则该溶液显 性。相关的离子方程式为 。
②若该溶液呈酸性,则溶液中的溶质为 。
③若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
A.c(Na+)>c(CH3COO-) B.c(CH3COO-)> c(Na+)
C.c(OH-)> c(Na+) D.c(Na+)> c(OH-)
E.c(OH-)>c(CH3COO-) F. c(CH3COO-)> c(OH-)
22.(8分)泡沫灭火器是常用的灭火器,其结构分内筒和外筒。内筒为塑料筒,外筒为钢筒。使用的药品为硫酸铝溶液和碳酸氢钠溶液,分盛在上述两筒中。使用时将灭火器倒置就会产生大量的二氧化碳和氢氧化铝等一起以泡沫的形式喷出。
(1)内筒所盛的药品是 ,为什么不能盛放在外筒中? 。
(2)产生泡沫的原理是什么?(用离子方程式表示) 。
(3)有人用碳酸氢钠晶体代替其溶液,你认为是否合理?为什么?
。
(4)有人用碳酸钠溶液代替碳酸氢钠溶液,你认为是否合理?为什么?
。
23.(12分)向体积为 2L 的固定密闭容器中通入 3molX 气体 , 在一定温度下发 生如下反应:2X (g) ![]() y (g) +3Z (g)
y (g) +3Z (g)
(1)经 5min 后反应达到平衡 , 此时测得容器内的庄强为起始时的 1.2 倍 , 则用 Y 表示的速率为 mol/L·min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行 , 在同一段时间内测得容器内的反应速率分别为 : 甲、 v (X) =3. 5 mol/L·min; 乙、 v (Y) =2 mol/L·min; 丙、 v (Z) =4. 5 mol/L·min; 丁、 v (X) =0. 075 mol/L·s 。若其它条件相同 , 温度不同 , 则温度由高到低的顺序是 ( 填序号〉
(3)若向达到 (1) 的平衡体系中充入氮气 , 则平衡向 ( 填"左"或"右"或"不)移动; 若向达到 (1) 的平衡体系中移走部分混合气体 , 则平衡向 ( 填 " 左 " 或 " 右 " 或 " 不 ") 移动。
(4)若在相同条件下向达到 (1) 所述的平衡体系中再充入 0.5molX 气体 , 则平衡后 X 的转化率与(1) 的平衡中的 X 的转化率相比较
A.无法确定 B.前者一定大于后者 c.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变 , 起始时加入 X 、 Y 、 Z 物质的量分别为 amol 、 bmol 、 cmol, 达到平衡时仍与 (1) 的平衡等效 , 则 : a 、 b 、 C 应该满足的关系为
(6)若保持温度和体积不变 , 起始时加入 X 、 Y 、 Z 物质的量分别为 amol 、 bmol 、 cmol, 达到平衡时仍与 (1) 的平衡等效 , 且起始时维持化学反应向逆反应方向进行 , 则 C 的取值范围应该 为
24.(8分)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有N2H4等。
(1)碳原子间可以形成链状结构,氮原子间也可形成链状结构,假设氮、氢原子间只以N-N键或N-H键形式连接,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的NH3对农业、化学和国防工业具有重要意义。其合成原理是:
![]() N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
①在一定温度下,将1molN2和4molH2气体通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内的压强为起始时的80%。此时反应放出的热量为 。
②保持温度不变,在相同的容器中,将起始时刻物质的量设为amolN2、bmolH2和cmolNH3,欲使平衡时NH3的物质的量分数为25%,则
I.达到平衡时,①与②放出的热量 (填字母)
A.一定相等 B.前者一定小于后者
C.前者等于或小于后者 D.前者等于或大于后者
II.若该反应正向进行,则a的取值范围是 。
五、计算题 (本大题包括两小题,共14分)
25.(9分)⑴高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g)![]() Fe(s)+CO2(g);△H>0,其平衡常数可表示为K=c(CO2)/c(CO),已知1373K时K=0.263。
Fe(s)+CO2(g);△H>0,其平衡常数可表示为K=c(CO2)/c(CO),已知1373K时K=0.263。
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)
②1373K时测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
⑵抽烟对人体有害,烟草不完全燃烧产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应CO(g)+Hb•O2(g)![]() O2(g)+Hb•CO(g),实验表明,Hb • CO的浓度即使只有Hb•O2浓度的2%,已足以使人的智力受损,试回答:
O2(g)+Hb•CO(g),实验表明,Hb • CO的浓度即使只有Hb•O2浓度的2%,已足以使人的智力受损,试回答:
③上述反应的平衡常数表达式为:K= 。
④已知37℃时,平衡常数K=220,抽烟后,测得吸入肺部的空气中的CO和O2的浓度分别为1×10-6mol/L和1×10-2mol/L,能否使人的智力受损 (填“能”或“否”), 理由是 。
26. (5分)常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为多少?
高二年级期末考试化学模拟试题(二)
1.C 2.D 3.D 4.A 5.D 6.C 7.C 8.A
9.C 10.C 11.C 12.C 13.A 14.C 15.A 16.BD 17.A 18.CD
19.(1)甲基橙。黄、橙。 (2)1000W/53·V
(3)提示:据Na2CO3——2HCl
106g 2mol
NaHCO3——HCl NaOH——HCl
84g 1mol 40g 2mol
所以等质量时,NaHCO3消耗HCl的体积最少。NaOH消耗Hcl的体积最多。
再据CHCl![]() ,可知:
,可知:![]() 消耗越多,CHCl越小。
消耗越多,CHCl越小。
故①C1 < C2 ②C1 > C2
20.(1)C (2)B (3)Fe3++3H2O![]() Fe(OH)3+3H+ CuO+2H+=Cu2++H2O
Fe(OH)3+3H+ CuO+2H+=Cu2++H2O
(4)将Fe3+氧化成Fe2+,便于生成沉淀而与Cu2+分离
(5)不能 应在HCl气流中蒸发
21. (1)加热浓缩,冷却结晶,过滤;Al3+ + 3H2O![]() Al(OH)3 + 3H+,在干燥的HCl气流中,可抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,故能得到无水AlCl3。
Al(OH)3 + 3H+,在干燥的HCl气流中,可抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,故能得到无水AlCl3。![]()
![]() (3)①(1)碱性 CH3COO-+H2O CH3COOH+OH-
(3)①(1)碱性 CH3COO-+H2O CH3COOH+OH-
②CH3COOH、CH3COONa ③B、C
22.(1)硫酸铝溶液 铝离子水解溶液显酸性会腐蚀钢筒,所以不能盛放在钢筒中
(2)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)不合理 由于碳酸氢钠在水中溶解度不大,水解时产生的Al(OH)3会覆盖在晶体表面,使反应停止
(4)不合理 与碳酸氢钠相比,产生相同量的CO2,碳酸钠耗酸多且产生CO2的速率慢。在酸量一定的条件下,用碳酸钠溶液代替碳酸氢钠溶液会使产生的CO2很少,甚至不能喷出泡沫
23.(1)0.03 (2). 丁>乙>甲>丙(3)不,右 (4)D (5) C=3b,a≥0(6)0.9<a≤4.5
24.(8分)(1)NmHm+2(m为正整数) (2) ① 46kJ;②I.D;II.0.5<a≤1
25.⑴①增大 ②否,大于,此时c(CO2)/c(CO)=0.25<k,反应向右进行
⑵③c(O2)• c(Hb• CO)/C(CO)• c(Hb• O2) ④能c(Hb• CO)/ c(Hb• O2)=2.2%>2%。
26.2.4