高二年级上册期末考试化学模拟试题(三)
第Ⅰ卷(选择题 )
一、选择题(每题只有一个正确选项,每题3分,共24分。)
1.根据电子排布的特点,Cu在周期表属于
A.s区 B.p区 C.d 区 D.ds区
2.下列说法正确的是( )
A.π键是由两个p电子“头碰头”重叠形成的
B.σ键是镜像对称,而π键是轴对称
C.乙烷分子中的键全是σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中还含有π键
3.下列指定粒子的个数比为2:1的是( )
A.Be2+中的质子数 B.12H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)晶体中的阴离子和阳离子
4.关于氢键的下列说法中正确的是( )
A.每个水分子内含有两个氢键 B.在水蒸气、水、冰中都含有氢键
C.分子间能形成氢键使物质的熔沸点升高
D.HF的稳定性很强,是因为其分子间能形成氢键
5.下列各组元素中,第一电离能依次减小的是( )
A.H Li Na K B.Na Mg Al Si C.I Br Cl F D.F O N C
6.若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了( )
A.能量守恒原理 B.泡利不相容原理
C.能量最低原理 D.洪特规则
7.下列不是元素电负性应用的是( )
A.判断一种元素是金属还是非金属 B.判断化合物中元素正负价
C.判断化学键类型 D.判断化合物溶解度
8.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.O2、I2、Hg B.CO2、KCl、SiO2 C.Na、K、Rb D.SiC、NaCl、SO2
二、选择题(每题有1—2个正确选项,每小题3分,共30分)
9.已知X、Y是主族元素,I为电离能,单位是KJ/mol。根据下表数据判断错误的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
A.元素X的常见化合价是+1价 B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
10.用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个。下列关于R的描述中正确的是( )
A.R的氧化物都能溶于水 B.R的最高价氧化物对应的水化物都是H2RO3
C.R都是非金属元素 D.R的氧化物都能与NaOH反应
11.下列关于主族元素的说法正确的是( )
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的最高正价等于主族的序数
D.主族元素的价电子数有可能超过最外层电子数
12.若某基态原子的外围电子排布为4d15s2,则下列说法正确的是: ( )
A.该元素基态原子中共有3个电子 B.该元素原子最外层共有3个电子
C.该元素原子核外有5个电子层 D.该元素原子M能层共有8个电子
13.下列说法正确的有 ( )
A.26 号元素铁属于d 区 B.主族共有7列,副族共有7列
C.在周期表中,元素周期数=原子核外电子层数
D.最外层电子数=8的微粒都属于是稀有气体元素
14.下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数;
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素;
C.除氦外的稀有气体原子的最外层电子数都是8;
D.同一元素的各种同位素的物理性质、化学性质均相同
15.下列叙述正确的是( )
A.熔融状态下能导电的物质一定是离子化合物 B.P4和NO2都是共价化合物
C.在氧化钙和二氧化硅晶体中都存在单个分子
D.离子化合物中一定不存在单个的分子
16.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A. K3C60中既有离子键又有极性键 B.该晶体在熔融状态下能导电
C.1mol K3C60中含有的离子数目为63×6.02×1023 D.该物质的化学式可写作KC20
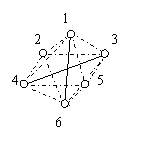 17.已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈
17.已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈
表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线
长度相等)。Co3+位于八面的中心,若其中三个NH3被Cl—取代,
所形成的[Co(NH3)Cl3]的同分异构体的数目为( )
A.1 B.2 C.3 D.4
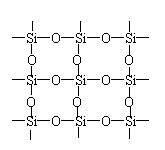 18.石英晶体的平面示意图如图所示,它实际上是网状结构,其中硅、氧原子的个数比是m:n,有关叙述正确的是( )
18.石英晶体的平面示意图如图所示,它实际上是网状结构,其中硅、氧原子的个数比是m:n,有关叙述正确的是( )
A.m:n=1:2
B.m:n=2:1
C.六聚硅酸根[Si6O18]y—中的y=10
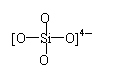 |
D.原硅酸根SiO44—的结构为 ,则二聚硅酸根离子Si2O7x—中的x=6
第Ⅱ卷(非选择题 )
三、填空题
19.(10分)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是____________
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外________________________________________________,如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(6)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________________________, 其中元素_______的第一电离能反常高的原因是
_________________________________________________________。
20.(6分)有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨HCN
既含有极性键的是又含有非极性键的是 ;只有σ键的是
既有σ键,又有π键的是 ;含有由两个原子的s轨道重叠形成的σ键的是 ;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是 ;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是 ;
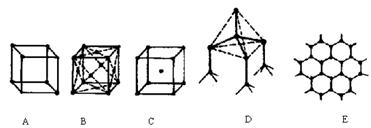
21.(9分)下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同)________,金刚石中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体;
(2)其中代表石墨是________,其中每个正六边形占有的碳原子数平均为________个;
(3)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻;
(4)上述三种物质熔点由高到低的排列顺序为________。
 |
22.(9分)1989年国际纯粹和应用化学联合会(IUPAC)的无机化学命名委员会建议将原长式周期表的ⅠA、ⅡA……族改为0、1、2……17共18列。
(1)第17列第3周期元素的名称和符号为 。
(2)72号元素铪(Hf)位于 周期,第 列。价电子构型为 。
(3)第2周期第2列元素Be是一种新兴材料,与同列元素相比,Be具有反常性质。写出BeCl2在气态(相对分子质量在80—160之间)和固态[(BeCl2)n]时的结构。
(4)若把稀有气体元素看作非金属,并假定元素周期表是有限的。请你预测周期表中应有 种非金属元素,还有 种尚未发现
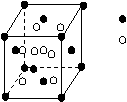 23.(9分)某离子晶体的晶胞结构如图。(该晶胞可看成由8个 X
23.(9分)某离子晶体的晶胞结构如图。(该晶胞可看成由8个 X
小立方体构成,在每个小立方体的体心各有一个白球,在大立 Y
方体的8个顶点和6个面心上各有一个黑球)试求:
①晶体中每一个Y同时吸引着 个X,每个X同时
吸引着 个Y,该晶体的化学式是 。
②晶体中在每个X周围与它最接近且距离相等X共有 个。
③晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为 。
④设该晶体的摩尔质量为M g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X间中心距离为 cm。
24.(8分)作为新一代工程材料,膨胀石墨有着广泛的新用途,如可做高级密封材料,也可作为新型的导电材料应用于电池生产中,还可以作为新型的吸附剂用于环保上。它可由石墨(garphite)在浓硫酸介质中被氧化而制得:
3nH2SO4+n graphite +n/2[O]==n/2H2O+[graphite+·HSO4·2H2SO4]n(石墨硫酸盐)
石墨硫酸盐经水洗、过滤、干燥、高温加热后即得膨胀石墨产品。
(1)你认为在实际生产工艺中是什么原因造成石墨膨胀而制成石墨材料?
(2)题给反应中的还原剂是 ,反应中转移电子总数为
(3)石墨硫酸盐中可能存在的作用力包括 。
四、计算题
25.(6分)一定压强和温度下,取两份等体积氟化氢气体,在35℃和90℃时分别测得其摩尔质量分别为40.0g/mol和20.0g/mol。
(1)35℃氟化氢气体的化学式为___________________
(2)不同温度下摩尔质量不同的可能原因是_______________________________
26.(9分)第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A有B的次外层电子数为8,而C与D的次外层电子数为18,根据结构填空:
(1)写出元素名称:A 、B 、C 、D 。
(2)D的简单离子是 。
(3)元素的氢氧化物碱性最强的是 。
(4)B原子与D原子间形成化合物的化学式为 。
(5)写出A、B的电离能顺序 。
(6)写出C基态原子的电子排布式 。
参考答案
1.D 2.C 3.A 4.C 5.A 6.D 7.D 8.B
9.D 10.C 11.BC 12.C 13.AB 14.AD 15.D 16.B 17.B 18.AD
19.(1)E (2)D (3)C (4)p,TCl3
(5)电子分层排布,各能层能量不同 ,9
(6)R<S<T,S,S元素的最外层电子处于s能级全充满,能量较低,比较稳定,失去一个电子吸收的能量较多
20.⑤⑥⑧ ①②③⑥⑦⑧ ④⑤⑨ ⑦ ①③⑤⑥⑧⑨ ②④⑤⑥⑧⑨
21.(1)D 4 原子 (2)E 2 (3)B 分子 12 (4)石墨>金刚石>干冰
22.(1)氯(Cl) (2)6 4 5d26s2
(3)由气态BeCl2相对分子质量在80—160之间可知存在BeCl2及(BeCl2)2分子,存在Be—Cl共价键。Be价电子层:1s22p0可有sp、sp2、sp3三种杂化形式。因价电子数少,有空轨道可与Cl形成配位键。
气态BeCl2:Cl—Be—Cl,
![]()
![]() Cl
Cl
![]()
![]() (BeCl2)2:Cl—Be Be—Cl ,
(BeCl2)2:Cl—Be Be—Cl ,
Cl
![]()
![]()
![]()
![]()
![]() Cl Cl
Cl Cl
![]()
![]()
![]()
![]() 固态:
固态:![]()
![]() … Be Be Be …
… Be Be Be …
Cl Cl
(4)23 1(稀有气体元素)
23.(1)4 8 XY2(或Y2X) (2)12 (3)109°28′ (4)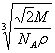
24.(1)(高温加热后)H2SO4、HSO4—和水分子在高温下迅速挥发,产生大量气体,从而使石墨膨胀。 (2)石墨(garphite) ne— (3)离子键、极性键和分子间作用力
25.(1)(HF)2 (2)在较低温度下HF以氢键结合而成(HF)n(n=2、3、……),其摩尔质量大于HF的摩尔质量;随着温度升高,氢键不断被破坏,气体摩尔质量减小。
26.(1)钾 钙 锌 溴(2)Br— (3)KOH (4)CaBr2 (5)K<Ca
(6)1s22s22p63S23p63d104s2