高二年级化学上学期期中考试试题
化学试题(选修)
考试时间:100分钟 分值:120分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27
S:32 Cl :35.5 Ca:40 Fe:56 Cu:64
注意事项:
1.回答第一卷前,考生务必将自己的姓名、准考证号,用书写黑色字迹的0.5毫米的签字笔填写在答题纸姓名栏内,并用2B铅笔涂写在答题卡上。
2.第一卷答案必须用2B铅笔填涂在答题卡上,在其它位置作答一律无效。每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
第I卷(选择题 共58分)
一、选择题(共6小题,每题3分,每小题只有一个正确答案;共计18分,答案请填入第II卷开始处相应表格内)
1、我国“嫦娥”已成功奔月。偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是 ( )
A、偏二甲肼(C2H8N2)的摩尔质量为60g
B、火箭发射时,偏二甲肼(C2H8N2)燃烧生成CO2、N2、H2O
C、偏二甲肼(C2H8N2)中所有原子最外层都达到8个电子
D、从能量变化看,主要是化学能转变为热能和动能,它是一种能量很高的烃
2、下列选项中能说明乙醇作为燃料的优点的是 ( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量热量
A、①②③ B、①②④ C、②③④ D、①②③④
3、下列事实中,不能用勒沙特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.加大压强更有利于合成氨
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
4、决定化学反应速率的根本因素是 ( )
A.温度和压强 B.反应物的浓度 C.催化剂的加入 D.参加反应的各物质的性质
5、下列数据是一些反应的平衡常数,其中表示反应进行得最接近完全的平衡常数是( )
A.K=1 B.K=10—1 C.K=1010 D.K=10—10
6、下列说法正确的是 ( )
A.活化分子的每一次碰撞都能够发生化学反应
B.能够发生有效碰撞的分子叫做活化分子
C.反应物用量增加后,有效碰撞次数增多,反应速率增大
D.加入催化剂对化学反应速率无影响
二、选择题(共10小题,每题4分,每小题有1~2个正确答案;共计40分,答案请填入第II卷开始处相应表格内)
7、完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐,消耗掉0.8mol/LNaOH溶液500mL,则燃烧1mol酒精放出的热量是 ( )
A、0.2Q B、0.1Q C、5Q D、10Q
8、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
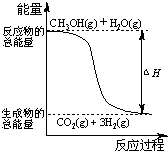 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= +
49.0 kJ·mol-1
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= +
49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是
A、CH3OH的燃烧热为192.9 kJ·mol-1
B、反应①中的能量变化如右图所示
C、CH3OH转变成H2的过程一定要吸收能量
D、根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
9、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
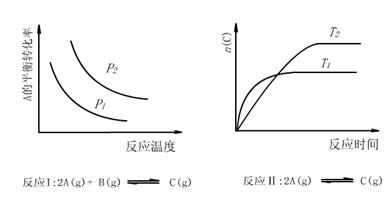
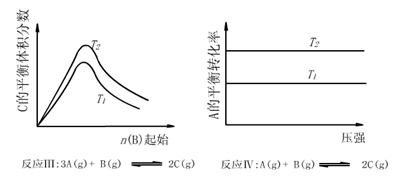
根据以上规律判断,下列结论正确的是 ( )
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
10、强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH—(aq)=H2O(1) △H = —57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H = —Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) +H2O(1) △H = —Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H = —Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为 ( )
A、Q1=Q2=Q3 B、Q2>Q1>Q3 C、Q2>Q3>Q1 D、Q2=Q3>Q1
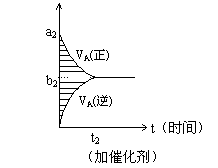 11、可逆反应m
A (g)+ n B(g)
11、可逆反应m
A (g)+ n B(g)![]() pC(g)+
g D(g)的v ~
t图像如下图,若其它条件都不变,只是在反应前加入合适的催化剂,则其v~t图像如下图。
pC(g)+
g D(g)的v ~
t图像如下图,若其它条件都不变,只是在反应前加入合适的催化剂,则其v~t图像如下图。
 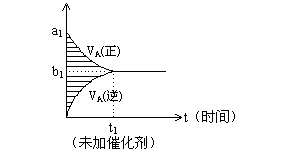 |
①a1 = a2 ②a1 < a2 ③b1 = b2 ④b1 < b2 ⑤t1>t2 ⑥t1= t2 ⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大,以上正确的为 ( )
A、②④⑤⑦ B、②④⑥⑧ C、②③⑤⑦ D、②③⑥⑧
12、一定条件下向一带有活塞的密闭容器中充入2molSO2和1molO2,发生如下反应:
2SO2(g) +O2(g)![]() 2SO3(g);达平衡后改变下列条件,SO3气体平衡浓度不改变的是( )
2SO3(g);达平衡后改变下列条件,SO3气体平衡浓度不改变的是( )
A、保持温度和容器的体积不变,充入1molSO2(g)
B、保持温度和容器内压强不变,充入1molAr(g)
C、保持温度和容器内压强不变,充入1molO2(g)
D、保持温度和容器内压强不变,充入1molSO3(g)
13、一定条件下,可逆反应N2 +3H2![]() 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
( )
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
( )
A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数
14、在同温同压下,下列各组热化学方程式中,△H2>△H1的是 ( ).
A、2H2(g) + O2(g)= 2H2O(g);△H1 2H2(g) + O2(g) = 2H2O(l);△H2
B.S(g) + O2(g) =SO2(g); △H1 S(s) + O2(g) = SO2(g);△H2
C、CO(g) + 1/2 O2(g) = CO2(g);△H1 2CO(g) + O2(g) = 2CO2(g);△H2
D、H2(g) +Cl2(g)=2HCl(g);△H1 1/2 H2(g) + 1/2 Cl2(g) = HCl(g);△H2
15、一定温度下,在密闭容器中可逆反应.N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡时体系的压强为反应前的 ( )
2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡时体系的压强为反应前的 ( )
A、1/5 B、3/4 C、9/11 D、1/2
16、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,又知:H2O(l)== H2O(g);△H= +44kJ/mol,下列热化学方程式,正确的是 ( )
A、1/3B2H6(g)+O2(g)==1/3B2O3(s)+H2O(g);△H= —677.7kJ/mol
B、B2H6(g)+3O2(g)== B2O3(s)+3H2O(g);△H= —2165kJ/mol
C、B2H6(g)+3O2(g)== B2O3(s)+3H2O(g);△H= —2033kJ/mol
D、B2H6(g)+3O2(g)== B2O3(s)+3H2O(l);△H= —2033kJ/mol
![]()
化学试题(选修)答题纸
第I卷(非选择题 58分)
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第II卷(非选择题 62分)
二、填空题(本题有5小题,共50分)
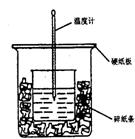 17、(10分)50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
17、(10分)50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(l)从实验装置上看,图中尚缺少的一种玻璃用品是 。由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 ;用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验,测得的中和热的数值会_____(均填“偏大”“偏小”“无影响”)
18、(6分)合成氨工业中(N2+3H2![]() 2NH3,ΔH
<0),原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:
2NH3,ΔH
<0),原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g) ![]() [Cu(NH3)3]AcCO(aq),此反应为放热反应。
[Cu(NH3)3]AcCO(aq),此反应为放热反应。
(1)必须除去原料气中CO的原因是________________________________________。
(2)用醋酸二氨合铜(I)吸收CO的生产适宜条件是 。
(3)吸收CO后的溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用,醋酸二氨合铜(I)再生的适宜生产条件是 。
19、(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为
mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
| 座位号 |
20、(9分)2006年2月15日,中国食疗网发布“反式脂肪酸预警报告”。专家指出,摄入过多的反式脂肪酸,会导致心脑血管疾病、糖尿病,儿童若摄入过多将会影响身体发育。人造奶油、快餐中的炸鸡和炸薯条均含有这种物质。反式脂肪酸是指至少含一个反式构型双键的脂肪酸。反式构型是指碳碳双键上与两个碳原子结合的氢原子分别位于双键的两侧,若两个氢原子位于双键的同侧则是顺式构型。
某医学杂志上用下图表示甲、乙两种物质的结构简式,这两个结构简式虽不是很符合有机物结构简式的书写规范,但还是能够清楚地表示甲、乙两种物质的结构特征。
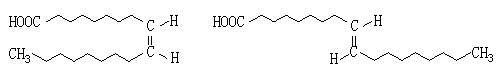
甲 乙
请根据你所学过的化学知识回答下列问题:
(1)写出甲的分子式 ,甲和乙可互称为 (填“同系物”或“同分异构体”或“同位素”)。你认为甲、乙两种哪一钟是反式脂肪酸 。
(2)你认为甲、乙两种物质能否在空气中燃烧? ,若你认为能够燃烧,请写出甲在足量氧气中燃烧的化学反应方程式 。
(3)顺式脂肪酸多为液态,空间呈弯曲状,反式脂肪酸多为固态,空间呈线型。血液中反式脂肪酸含量过高容易堵塞血管而导致心脑血管疾病。原因是 。
(4)在油脂催化加氢(如制备人造奶油、酥油)过程中,构型会发生变化。另外,油脂长时间高温加热,也会产生反式脂肪酸。若a g甲转化成乙吸收Q kJ热量,写出该热化学反应方程式 (用“甲”、“乙”表示物质的分子式)
21、(13分)M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,可用于制头盔、防弹背心和刚性前后防护板。下图是有关M5纤维等有机物的转化关系图(部分反应未注明条件):
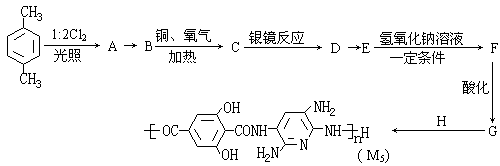
(1)写出下列物质的结构简式:E ;H ;
(2)反应类型:A→B ;B→C ;
(3)生成A的同时可能生成A的同分异构体的结构简式: ;
(4)写出化学反应方程式:C→D ;E→F ;
(5)1 mol的G与Na2CO3溶液反应,最多消耗Na2CO3 mol;
(6)试分析M5纤维为什么具有极高的强度 。
三、计算题:(计12分)
22、在673K,![]() 的条件下,有1mol气体A发生如下反应,2A(g)
的条件下,有1mol气体A发生如下反应,2A(g)![]() xB(g)+C(g)在一定条件下已达平衡,在平衡混合气中A的体积分数为50.0%,平衡时总物质的量为1.2moL,混合气体总质量为46g ,求:
xB(g)+C(g)在一定条件下已达平衡,在平衡混合气中A的体积分数为50.0%,平衡时总物质的量为1.2moL,混合气体总质量为46g ,求:
(1)达平衡后混合气体的平均分子量
(2)A的转化率
(3)x的值
(4)相同条件下反应物A气体的密度是平衡混合气体密度的几倍。
化学试题(选修)参考答案
第I卷(选择题 58分)
一、二、选择题(共16小题,计58分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | B | D | C | B | D | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | BC | C | A | D | C | BC | C | AC |
第II卷(非选择题 62分)
二、填空题(本题有5小题,共50分)
17.(10分,每空1分)
(l)环形玻璃搅拌棒;(1分)在大小烧杯间填满碎泡沫(或纸条)使小烧杯口与大烧杯口相平;(1分) (2)减少实验过程中的热量损失;(1分) (3)偏小 ;(1分)(4)不等;(1分)相等;(1分)因为酸、碱发生中和反应放出的热量与酸、碱的用量有关,而中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。与酸、碱的用量无关 ;(2分)(5)偏小;(1分)偏小;(1分)
18、(6分,每空2分)(1)CO会引起催化剂中毒。(2)高压、低温。(3)高温、低压。
19、(12分)
(1)(1-a);(1分) (2)3a ;(1分)(3)2 ;(1分) 3-3a ;(1分) 丁;(1分)
若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol(2分)
(4)![]() ; (2分)
; (2分)
(5)乙 ;(1分) 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。(2分)
20、(9分) (1)C18H34O2(1分) 同分异构体(1分) 乙 (1分)
(2)能够燃烧(1分) C18H34O2+51/2 O2→18CO2+17H2O (2分)
(3)顺式脂肪分子间空隙大,分子间作用力相对比较弱,反式脂肪分子间空隙小,分子作用力相对比较大,所以反式脂肪酸熔点较低,大多为固态物质,在血管中易形成“堵块”而堵塞血管。(1分,只要答到“分子空隙大小”“分子间作用力大小”等要点就给分。
(4)甲(l)→乙(s):△H=282Q/a kJmol–1(2分,反应热计算错扣1分)
21、(13分)
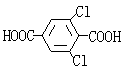 | |||
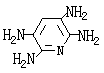 | |||
(1) (1分) (1分)
(2)取代(水解)(1分) 氧化反应(1分)
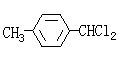
(3) (2分)
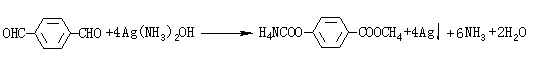 (4)
(4)
(2分)
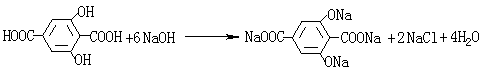 (2分)
(2分)
(5)4 mol (2分)
(6)M5纤维分子中有极性很强的O-H、N-H键,它们之间可形成氢键。(1分)
三、计算题:(计12分)(计算题没有过程不给分)
22、(1)38.3 (2)40.0% (3)2 (4)1.2