高二年级化学上学期第二次月考试题
化 学
可能用到的相对原子质量:
C---12 H—1 P—31 Si—28 O—16 Na—23
Cu—64 S—32 Cl—35.5
一选择题(3′×8=24′,每小题只有一个正确的选项)
1、关于晶体的下列说法正确的是
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低
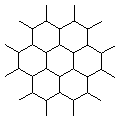 2、石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是
2、石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是
A.10个 B.18个 C.24个 D.14个
3.下列过程中,需要吸收能量的是
A、H+H=H2 B、H+Cl=HCl
C、I2→I+I D、S+O2=SO2
4.下列各项与反应热的大小无关的是
A.反应物和生成物的状态 B.反应物量的多少
C.反应物的性质 D.反应的快慢
5.下列说法正确的是
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果未注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
6.热化学方程式C(s)+H2O(g)![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
7、1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。下列热化学方程中,能直接表示出氯化钠晶体格能的是
A.Na+(g)+Cl-(g) NaCl(s); △H B.Na(s)+![]() Cl2(g)
Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2
D.Na(g)-e- Na+(g); △H
8、在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125KJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H =-23.4kJ/mol,以上事实表明
A.1,3—环己二烯加氢是吸热反应 B.苯加氢生成环己烷是吸热反应
C.1,3—环己二烯比苯稳定
D.苯比1,3—环己二烯稳定
二.选择题(4′×10=40′,可能有1-2个正确答案)
9、下列各项所述的数字不是6的是
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
10、下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4含有p—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSi02中含Si—O键的个数为2NA
11、下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
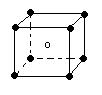
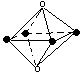
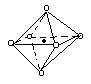
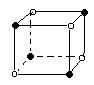
⑴ ⑵ ⑶ ⑷
A、⑴ B、⑵ C、⑶ D、(4)
12、能增加反应物分子中活化分子的百分数的是( )
A.升高温度 B.使用催化剂 C.增大压强 D.增加浓度
13、下列说法正确的是( )
A、吸热反应在一定条件下也可以发生
B、需要加热才能发生的反应一定是吸热反应
C、反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D、放热反应在常温下一定很容易发生
14、已知:2A(g)+B(g)==C(g)△H1;D(g)+B(g)==E(g)△H2;若A、D、混合气体1mol完全与B反应,放出热△H3,则A、D的物质的量之比是 ( )
A、(△H2-△H3 ):2(△H1-△H3) B、(△H3-△H2 ):(△H1/2-△H3)
C、(△H3-△H2 ):(△H3-△H1/2) D、(△H1/2-△H2 ):(△H3-△H2)
15、已知:C(s,金刚石)=C(s,石墨)△H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是
A、 △H1=△H2 B、△H1>△H2
C、△H1<△H2 D、金刚石比石墨稳定
16、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);
△H=-57.3kJ/mol,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1=△H3>△H2 D.△H1>△H3>△H2
17、100gC不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:
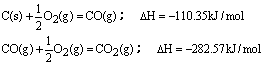
与这些碳完全燃烧相比,损失的热量为( )
 A.39.292kJ B.3274.3kJ C.784.92kJ D.2489.44kJ
A.39.292kJ B.3274.3kJ C.784.92kJ D.2489.44kJ
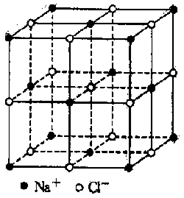
18、食盐晶体如右图所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
A. ![]() cm
B.
cm
B. ![]() cm
cm
C ![]() cm
D.
cm
D. ![]() cm
cm
高二年级化学上学期第二次月考试题
化 学 (答案纸)
请把选测答案填入下表:
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| ||
| 答 案 |
| ||||||||||
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 19 |
|
| 答 案 | |||||||||||
三.填空题(共44)
19、(本题共8分)
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。
出571.6kJ的热量。H2的燃烧热为 ,
表示H2燃烧热的热化学方程式为__________
__。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,
出114.6kJ的热量,该反应的中和热为__________ ,
表示其中和热的热化学方程式为____________ ________。
20、(本题共13分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。
(1)现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+![]() CO(g)==
CO(g)== ![]() Fe3O4(s)+
Fe3O4(s)+ ![]() C02(g)
△H=-15.73kJ/mol
C02(g)
△H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式
(2)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
1肼和二氧化氮反应的热化学方程 ;
2有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
(3)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃料水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
1途径Ⅰ放出的热量_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
2ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是______ _________。
21、(本题共9分)称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。
(1)胆矾的溶解热为___ __ _kJ·mol—1,是___
___(填”吸热”或“放热”下同)
(2)无水硫酸铜的溶解热为___ ___kJ·mol—1,是___ ___过程。
(3)从以上数据可知,胆矾脱水是____ __过程,1mol胆矾脱水需 __
_
_kJ·mol—1热量
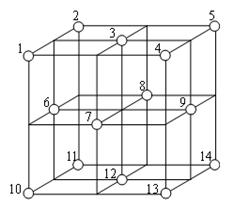 22、(本题共14分)
22、(本题共14分)
(1)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-
通过离子键而组成的复杂离子晶体。O2-的
重复排列方式如上图所示,该排列方式中存
在着两种类型的由O2-围成的空隙,
 如1、3、6、7的O2-围成的空隙和
如1、3、6、7的O2-围成的空隙和
3、6、7、8、9、12的O2-围成的空隙,前
者为正四面体空隙,后者为正八面体空隙,
Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,
1正四面体空隙数与O2-数之比为______ _,
2其中有_____ _%正四面体空隙填有Fe3+,
有_______ _%正八面体空隙没有被填充。
(2)金属Al单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
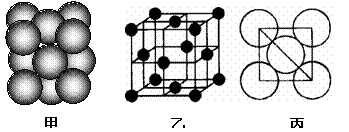 |
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
① 晶胞中Al原子的配位数为__ _ ,
② 一个晶胞中Al原子的数目为_ _;
3该晶体的密度为______ _ (用字母表示)。
四、计算题(共2 题,共计12 分)
23(1)据了解,我国兴建的三峡工程提供的水力发电功率相当于3000万kW的火力发电站。因此,三峡建设将有助于控制( )
A. 温室效应 B. 白色污染 C. 城市污水的任意排放 D. 长江中、下游的洪涝灾害
(2)已知1 g碳粉在氧气中完全燃烧放出的热量是32.8 kJ(与1g 原煤相当),试写出相关的热化学方程式: 。
(3)若以火力发电,要达到3000万kW的功率,每天至少要消耗原煤多少吨
(1千瓦时=3.6×106 J,燃煤热能转化为电能的转化率为50 %)。
24、在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比。
高二年级化学上学期第二次月考试题
化 学 (答案纸)
1A 2D 3C 4D 5C 6C 7A 8D
9C 10BC 11BC 12AB 13AC
14B 15 C 16D 17C 18B
19(1)285.8kJ/mol
![]() ;△H=-285.8kJ/mol
;△H=-285.8kJ/mol
(2)57.3kJ/mol
![]() ;△H=-57.3kJ/mol
;△H=-57.3kJ/mol
20.(1)CO(g)+FeO(s)= Fe(s) + C02(g) △H=-218.00 kJ/mol 。
(2)2N2H4 (g) +2NO2 (g) = 2N2(g) +4H2O (g) △H = -1153.7 kJ/mol
N2H4 (g) + F2 (g) = N2(g) +4HF (g) △H = -1135 kJ/mol
(3)等于 (2)ΔH1=ΔH2+![]() (ΔH3+ΔH4)
(ΔH3+ΔH4)
21解析:
答案: (1)250Q1/a 吸热
(2)250Q2/a 放热
(3)吸热 250(Q1+Q2)/a
22(1) 2:1 12.5% 50%
(2)12; 4 ②
23(1)AD
(2)C (s) + O2 (g) = CO2(g) △H = -393.6 kJ/mol
(3)解:设每天要消耗原煤为x
3×107 kW×24 h×3.6×103 kJ/(kW·h) = x÷12×393.6×50%
x = 15.8×1010 g = 1.58×105吨
24.解:设燃烧后共生成二氧化碳x,混合气体中甲烷的物质的量为a,一氧化碳的物质的量为b
CaCO3 ~ CO2
100 1
50g x x = 0.5 mol
![]() 890 kJ/mol a + 566/2
kJ/mol b = 262.9 kJ
890 kJ/mol a + 566/2
kJ/mol b = 262.9 kJ
a + b = 0.5 解出a = 0.2 mol b = 0.3 mol
a/b = 2/3