高二年级化学上期期中五校联考试卷
化学
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 P:31 Na:23 N:14 Ca:40 Fe:56 Cu:64
说明:本试卷分为第I卷和第II卷,满分100分,考试时间90分钟。将正确答案写在答题纸上,考试结束只交答题纸。
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.下列试剂的保存方法,错误的是:
A.把浓硝酸放在棕色瓶中,并置于冷暗处保存
B.把AgNO3放在棕色瓶中保存
C.把红磷放在广口瓶中密闭保存,把白磷保存在煤油中保存
D.把NaOH溶液放在带橡皮塞的玻璃瓶中保存
|
| a(干燥气体) | B(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol·L-1盐酸 |
3.下列离子方程式正确的是
A. 苏打溶液中滴入少量稀盐酸:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
B. 漂白粉溶液中通入过量CO2:Ca2++ 2ClO-+CO2+H2O=2HClO+ CaCO3↓
C. 三氯化铁溶液中滴入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3![]()
D. 稀硝酸中加入少量铁粉:3Fe+ 4H++2NO3-= 3Fe2++2NO↑+ 2H2O
4.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述正确的是
A.NH4H是共价化合物 B.NH4H溶于水,所形成的溶液显碱性
C.NH4H与水反应时,水被氧化 D.NH4H中的H元素均为+1价
5.NA表示阿伏加德罗常数,下列说法正确的是
A.1mol任意比例混合的CH4和NH3中,所含电子数均为10 NA
B.标准状况下,22.4L NO2和NO的混合气体中气体分子总数为2NA
C. 22.4 L N2中所含的分子数为NA
D.1mol白磷中含有共价键的数目为4NA
6.下列各组离子在溶液中能大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀。该组离子可能是
A.Na+、Ba2+、NO3-、CO32- B.NH4+、K+、SO42-、HCO3-
C.Mg2+、NH4+、SO42-、Cl- D.Fe2+、Na+、SO42-、NO3-
![]() 7.在一定温度下,A2(g)+B2(g) 2AB(g)达到平衡的标志是:A.单位时间内减少n mol A2,同时生成2n mol
AB
7.在一定温度下,A2(g)+B2(g) 2AB(g)达到平衡的标志是:A.单位时间内减少n mol A2,同时生成2n mol
AB
B.单位时间内生成n mol B2,同时生成n mol AB
C.单位时间内生成 2xmol AB, 同时生成xmol A2
D.容器内各组成成分的物质的量之和不随时间变化而变化
8.当下列反应达到平衡时保持温度不变,向容器中通入氩气,则化学平衡一定不移动的是:
![]() A.PCl5(g) PCl3(g)+Cl2(g)
A.PCl5(g) PCl3(g)+Cl2(g)
![]() B.N2(g)+3H2(g) 2NH3(g)
B.N2(g)+3H2(g) 2NH3(g)
![]() C.2HI(g)
H2(g)+I2(g)
C.2HI(g)
H2(g)+I2(g)
![]() D.C2H4(g)+H2(g) C2H6(g)
D.C2H4(g)+H2(g) C2H6(g)
9.已知某可逆反应:mA(g)+nB(g) ![]() xC(g) (正反应为放热反应),在密闭容器中进行,下图表示反应在不同时间t ,温度T和压强P下,C在混合气体中的百分含量(C%)的关系曲线,则下列说法正确的是:
xC(g) (正反应为放热反应),在密闭容器中进行,下图表示反应在不同时间t ,温度T和压强P下,C在混合气体中的百分含量(C%)的关系曲线,则下列说法正确的是:
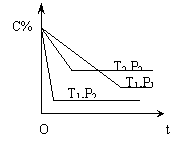
A.T1>T2 ,P1>P2 ,m+n>x ,正反应为放热反应
B.T1<T2 ,P1<P2 ,m+n<x ,正反应为吸热反应
C.T1>T2 ,P1<P2 ,m+n<x ,正反应为放热反应
D.T1<T2 ,P1>P2 ,m+n>x ,正反应为吸热反应
10.下图是合成氨的简要流程示意图
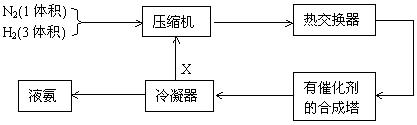
沿X路线回去的物质是
A. N2和H2 B. 催化剂 C. NH3 D. H2
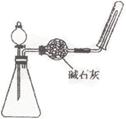 11、利用右图装置,可用于制取下列气体中的
11、利用右图装置,可用于制取下列气体中的
A.NO B.Cl2 C.O2 D.NH3
12、足量的铁与下列酸反应,相同条件下产生H2的体积最大的是
A.20mL6mol/L盐酸 B.40mL2mol/L硫酸
C.30mL3mol/L硝酸 D.10mL18.4mol/L硫酸、
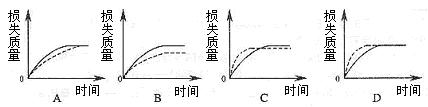
13、将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A>B)粉末状碳酸钙与同浓度足量盐酸反应,则相应的曲线(图中虚线所示)正确的是
14、常温时,以下4种溶液pH最小的是
A.0.01mol ·L-1醋酸溶液
B.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积混合液
C.0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
15.等质量的CuO和MgO粉末分别溶于相同体积的足量硝酸中,得到Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为
A.a=b B.a=2b C.2a=b D.a=5b
二、填空题(本题共2小题,共20分)
16.(10分)已知![]() 在酸性条件下,发生还原反应后的产物为NO;发生氧化反应后的产物为
在酸性条件下,发生还原反应后的产物为NO;发生氧化反应后的产物为![]() 。现有稀H2SO4 、NaOH溶液、氨水、KMnO4溶液、KI淀粉溶液、NaNO2溶液等试剂。请用简捷、实验现象明显的方法来说明亚硝酸根既具有氧化性又有还原性。(已知MnO2在酸性条件下遇还原剂可转变成Mn2+ )
。现有稀H2SO4 、NaOH溶液、氨水、KMnO4溶液、KI淀粉溶液、NaNO2溶液等试剂。请用简捷、实验现象明显的方法来说明亚硝酸根既具有氧化性又有还原性。(已知MnO2在酸性条件下遇还原剂可转变成Mn2+ )
(1) 说明![]() 具有氧化性,应选用的试剂有_________________;发生的现象是______________;反应的离子方程式为___________。
具有氧化性,应选用的试剂有_________________;发生的现象是______________;反应的离子方程式为___________。
(2) 说明![]() 具有还原性,应选用的试剂有__________________;发生的现象是_____________;反应的离子方程式为__________。
具有还原性,应选用的试剂有__________________;发生的现象是_____________;反应的离子方程式为__________。
17.(10分)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是 ;
(2)Y是 ,Z是 ,W是 ;
(3)Y单质的电子式为 ;写出一个由Y单质转化为其化合物的化学方程式: ;
(4)由X、Y、Z和W 组成的两种化合物在水溶液中反应可生成一种无色有刺激性气味的气体,试写出该反应的离子方程式:
。
三、推断题(本题共1小题,共7分)
18、下图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,F可用作化肥,也可用来作炸药。
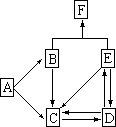
(1)请列举出D的两种危害① ②
(2)写出F的化学式 ;
(3)写出下列变化的化学方程式:
![]() B→C:
B→C:
![]() E→D:
E→D:
四、实验题:(本题共1小题,共7分)
19、为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。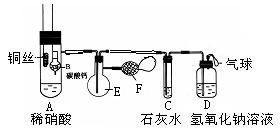
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先排出去其中的空气。你第一步实验操作为:__________________;
确定E中空气已被赶尽的实验现象为:______________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2?
________________________________________________________一段时间后,C中白色沉淀溶解,其原因是_____________
(4)装置D的作用是_____________________________________
五、(本题包括2小题,共14分)
20、(6分)
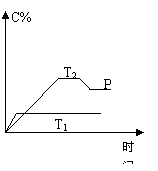 在一定条件下,可逆反应A + B
在一定条件下,可逆反应A + B ![]() mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
(1)温度T1 T2(填大于、等于或小于)
正反应是 反应(填“吸热”或“放热”)
(2)如果A、B、C均为气体,则m 2(填大于、等于或小于)
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强 ,平衡 移动。
(4)当温度和压强不变时,如在平衡体系中加入一定量的某稀有气体,平衡 移动。
21.(8分)
(1)在25℃条件下将pH=3的醋酸溶液稀释100倍,稀释后溶液的pH为(填序号)__________。
A.3 B.5 C.2~3之间 D.3~5之间
(2)25℃时,向![]() 的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是_______ 。
的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是_______ 。
(3)室温下,向0.1mol·L-1的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入
试剂
(4)常温下,0.1mol·L-1的醋酸和PH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者 (添“大” ,“小” 或“等”
六、计算(本题包括1小题,共7分)
22. 一定温度下,在一固定容积的密闭容器中如下反应:
A(g)+2B(g)![]() 3C(g).已知加入1molA和3molB且达到平衡后,生成amolC.
3C(g).已知加入1molA和3molB且达到平衡后,生成amolC.
(1)达到平衡时C在反应混合气中的体积分数是 (用含字母a的式子表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6molB,达到平衡后,C的物质的量为 mol(用字母a表示)。此时C在反应混合气中的体积分数 (填增大,减小或不变)。
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中体积分数不变,则还应加入C
mol.
(4)在同一容器中加nmolA和3nmolB,则平衡时C的物质的量为m mol.若改变实验条件,可以使C的物质的量在m~2m间变化。那么,n与m的关系是 (用字母n、m关系式表示)。
五校联考化学答题纸
一、选择题(45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | |||
| 答案 |
二、填空题(本题共2小题,共20分)
16.(10分)
(1) _________________ ;
______________ ;
__________ _。
(2) __________________ ;
_____________ ;
__________ 。
17.(10分)
(1) ,理由是 ;
(2)Y ,Z ,W ;
(3) ;
;
(4)
。
三、推断题(本题共1小题,共7分)
18、
(1)① ② 。
(2) ;
(3)B→C: ;
E→D: 。
四、实验题:(本题共1小题,共7分)
19、(1)__________________ ;
______________________ 。
(2) 。
(3)_________________________________________________;
_____________ 。
(4)_____________________________________ 。
五、(本题包括2小题,共14分)
20、(6分)
(1)T1 T2
正反应是 反应
(2)m 2
(3)体系的压强 ,平衡 移动。
(4)平衡 移动。
21.(8分)
(1)__________。
(2) ______ _。
(3) 。
(4) 。
六、计算(本题包括1小题,共7分)
22.
(1) 。
(2) mol;
。
(3) mol。
(4) 。
参考答案:
一、(45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | C | B | A | D | C | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | |||
| 答案 | A | D | B | C | A | C |
二 、
16、(1) NaNO2溶液、KI淀粉溶液、稀H2SO4;(2分)
溶液变蓝;(1分)
4H++2![]() +2I- =I2+2NO↑+2H2O (2分)
+2I- =I2+2NO↑+2H2O (2分)
(2) NaNO2溶液、KMnO4溶液、稀H2SO4;(2分)
溶液紫色褪去;(1分)
5![]() +2
+2![]() +6H+ =5
+6H+ =5![]() +2Mn2++3H2O(2分)
+2Mn2++3H2O(2分)
17、(1)否,(1分)
若三者处于同一周期,则最外层电子数之和不可能为17。(1分)(2)N,O,S(3分)
![]() (3)
(1分)
(3)
(1分)
![]() N2+3H2
N2+3H2![]() 2NH3 或 N2+O2
2NO或其它合理答案(2分)
2NH3 或 N2+O2
2NO或其它合理答案(2分)
(4)SO32-+2H+=SO2↑+H2O或HSO3-+ H+=SO2↑+H2O
或SO32-+2HSO4-= SO42-+SO2↑+H2O
或HSO3-+ HSO4- = SO42-+SO2↑+H2O (2分)
三、
18、(1)引起光化学烟雾;污染大气;造成酸雨 答出任意两点即得2分
(2)NH4NO3 (1分)
(3)4NH3+5O2![]() 4NO+6H2O (2分)
4NO+6H2O (2分)
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O
或4HNO3(浓)![]() 4NO2↑+O2↑2H2O(2分)其它合理答案也可
4NO2↑+O2↑2H2O(2分)其它合理答案也可
四、
19、(1)放下B使碳酸钙和硝酸反应(1分)
有白色沉淀产生(1分)
(2)3Cu+8 H++2NO3-=3Cu2++2NO+4H2O(2分)
(3)鼓入空气变红棕色(1分)、 生成硝酸 (1分)
(4) 尾气吸收(1分)
五、
20、(1)> (1分) 放热(1分) (2)> (1分) (3)增大(1分) 不(1分) (4)正反应方向(1分)
21、
(1)D (2分) (2)醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使![]() 减小(2分)
减小(2分)
(3)醋酸钠 (2分)(4)小(2分)
六、
22.(1)0.25a(1分) (2)2a(1分),不变(1分) (3)6(2分)
(4)n>![]() m(2分)
m(2分)