高二年级化学科化学反应原理试题
说明:1、本卷分值100分,测试时间90分钟。
2、设计和组合:黄德清。命制时间:2007年1月13日。
3、可能用到的相对原子质量:H~ 1,C~ 12,N~ 14,O~ 16, Na~ 23,
S~ 32,Cl~ 35.5,K~ 39,Fe~ 56,Cu~ 64,Zn~ 65 。
第一部分 选择题(共62分)
一、选择题(本题包括10小题,共20分。每小题只有一个选项符合题意)
1、根据热化学方程式(在101kPa时)∶
S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中不正确的是( )
A.S的燃烧热为297.23kJ/mol
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(g) + O2(g) = SO2(g) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的总能量大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的总能量
2、在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)。若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是( )
A、3.6mol B、3.2mol C、2.8mol D、1.6mol
3、一定条件下反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是( )
2AB(g)达到平衡状态的标志是( )
A.υ(正、A2)= υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
4、在一定的温度下, 向一密闭容器中放入 1
mol A 和 1 mol B, 发生下列反应: A(g) + B(g) ![]() C(g) + 2D(g),平衡状态时,C的含量为 m%,保持温度不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是( )
C(g) + 2D(g),平衡状态时,C的含量为 m%,保持温度不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是( )
A. 2mol A + 1mol B B. 1 mol C + 1 mol D
C. 2mol C + 2mol D D. 0.5mol A +0.5mol B +0.5 molC +1mol D
5、已知25℃时,下列酸的电离常数:
醋酸:![]() 氢氰酸:
氢氰酸:![]()
氢氟酸:![]() 甲酸:
甲酸:![]()
则物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是( )
A、 醋酸 B、 氢氰酸 C、氢氟酸 D、甲酸
6、钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A、2H+ +2e- = H2↑ B、Fe2+ + 2e- = Fe
C、2H2O + O2 + 4e- = 4OH- D、Fe3+ + e- = Fe2+
7、碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:
Zn + 2MnO2 + 2 H2O = Zn(OH)2 + 2MnOOH
在此电池放电时,正极(碳棒)上发生反应的物质是( )
A、Zn B、碳棒 C、MnO2 D、MnO2和H2O
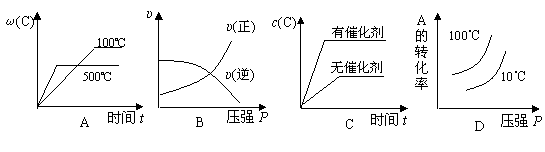
8、对于可逆反应:2A(g)+B(g)![]() 2C(g) △H<0,下列各图正确的是( )
2C(g) △H<0,下列各图正确的是( )
9、下列各变化中属于原电池反应的是( )
A、在空气中金属铝表面迅速氧化形成保护层
B、镀锌铁表面有划损时,也能阻止铁被氧化而生锈
C、红热的铁丝与冷水接触,表面形成蓝黑色保护层
D、浓硝酸比稀硝酸更能氧化金属铜
10、A、B、C是三种金属,根据下列 ①、② 两个实验:
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;
②电解物质的量浓度相同的A、C混合盐溶液时,阴极上先析出C(使用惰性电极)。确定它们的还原性强弱顺序为( )
A、A>B>C B、B>C>A C、C>A>B D、B>A>C
二、选择题(本题包括14小题,每小题3分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
11、在一定的温度下, 将 2mol SO2和1mol O2充入一定容密闭容器中, 在催化剂存在下进行下列反应: 2SO2(g) + O2(g) ![]() 2SO3(g) △H =-197 kJ/mol, 当达到平衡状态时, 下列说法中正确的是( )
2SO3(g) △H =-197 kJ/mol, 当达到平衡状态时, 下列说法中正确的是( )
A. 生成 SO3 2 mol B. 放出 197 kJ 的热量
C. SO2 的转化率小于100% D. 平衡时压强不再改变
12、在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a > b
13、加入正催化剂使反应速率加快,下列叙述不正确的是( )
A. 使反应体系的活化能降低。
B. 使反应体系的活化分子总数增多。
C. 使反应体系的活化分子百分数降低。
D. 使反应体系的活化分子百分数增大。
14、不能用于判断HA是弱电解质(弱酸)的依据是( )
A、浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。
B、PH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。
C、浓度相等的HCl与HA两溶液,C(HCl中H+)约是C(HA中H+)的100倍。
D、PH相等的HCl与HA两溶液,C(HA)约是C(HCl)的100倍。
|
溶液的物质的量浓度和完全反应后溶液
的大致体积是( )
A、1.0mol·L-1、 60mL
B、0.5mol·L-1、 80mL
C、0.5mol·L-1、 40mL
D、1.0mol·L-1、 80mL
16、下列各组溶液充分混合后,混合液的PH一定大于7的是( )
A、PH=3的醋酸与PH=11的NaOH等体积混合
B、PH=2的盐酸与PH=12的Ba(OH)2等体积混合
C、0.1mol·L-1的酸性溶液与0.2mol·L-1的碱性溶液等体积混合
D.PH = 9的溶液稀释至1000倍
17、把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
A、(CH3COO-)>C(Na+) B、C(CH3COOH)+C(CH3COO-)=0.01mol/L
C、C(CH3COOH)>C(CH3COO-) D、无法判断
18、表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度的关系式中正确的( )
A、C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-)
B、C(Na+) = C(HCO3-)
C、C(Na+)+C(H+) = C(HCO3-)+2C(CO32-)+C(OH-)
D、C(Na+) = C(HCO3-)+C(CO32-)+C(H2CO3)
![]() 19、下列离子方程式正确的是( )
19、下列离子方程式正确的是( )
A、 碳酸的电离
H2CO3 H+
+ HCO3-
B、 将金属钠加入水中 Na + 2H2O = Na+ + 2OH- + H2↑
C、 硫化钠水解 S2- + 2H2O = H2S↑ + 2OH-
D、向氯化铝溶液中加入过量的烧碱溶液 Al3+ + 3OH-= Al( OH )3↓
20、在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的
是( )
A、 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN-
B、 pH值为1的溶液
Cu2+、Na+、Mg2+、NO3-
C、 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
D、 所含溶质为Na2SO4的溶液
K+、CO32-、NO3-、Al3+
21、用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24 L气体(标准状况)。下列有关说法正确的是( )
A、阴极生成的铜为5.6g
B、上述电解过程中共转移0.2 mol电子
C、电解得到的Cu的物质的量为0.5mol
D、电解后溶液呈碱性
22、物质的量浓度相同的下列溶液中,符合PH由小到大顺序排列的是( )
A、Na2CO3 NaHCO3 NaCl NH4Cl
B、NaHCO3 Na2CO3 NH4Cl NaCl
C、NH4Cl (NH4)2SO4 Na2S NaNO3
D、(NH4)2SO4 NH4Cl NaNO3 Na2S
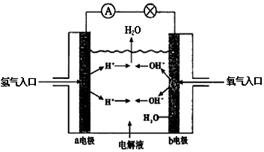 23、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
23、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
A、a电极是负极
B、b电极的电极反应为:
4OH--4 e-=2H2O +O2
C、电池工作时,电子由正极通过
外电路流向负极
D、氢氧燃料电池是一种具有应用前景的绿色电源
24、银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解
![]() 质为KOH。其电池总反应为Ag2O
+ Zn + H2O 2Ag + Zn(OH)2
,则
质为KOH。其电池总反应为Ag2O
+ Zn + H2O 2Ag + Zn(OH)2
,则
下列说法正确的是( )
A、放电时Ag2O参与反应的电极为负极
B、放电时正极附近的pH逐渐增大
C、充电时阴极的电极反应为:Zn(OH)2 + 2e-= Zn + 2OH-
D、充电时每生成1 mol Ag2O转移1 mol电子
第二部分 非选择题 (共38分)
三、(本大题包括2个小题,共21分)
25、(7分)氯化铁水解的离子方程式为 ,配制氯化铁溶液时滴加少量盐酸的作用是 ;
若向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐逐渐溶解,并产生无色气体,其离子方程式为 ,同时有红褐色沉淀生成的原因是
。
26、(14分)为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A、冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B、用某仪器量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C、将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D、将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E、在锥形瓶下垫一张白纸,滴定至恰好反应为止,记下读数为V2mL。
F、把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G、用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
(1)正确操作步骤的顺序(用编号字母填写) → A → →
→ → → 。
(2)用来量取10.00mL浓硫酸的仪器是 。
(3)滴定中可选用的指示剂是 。滴定中,目光应注视 ;判断滴定恰好完成的依据是
;读数时,目光与凹液面的最低处保持水平。
(4)某学生实验时用稀硫酸润洗了锥形瓶,测定的浓度会偏 。
(5)该浓硫酸样品纯度的计算式为 。
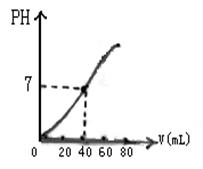
(6)若用0.1000 mol/L的NaOH溶液滴定20.00mL0.1000 mol/L的CH3COOH溶液,跟踪测试和记录的滴定过程中溶液PH的结果如下,请根据下表数据绘制PH随加入NaOH溶液的滴定曲线。
| 滴入HCl的体积 | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 40.00 | |
| PH | 2.88 | 5.70 | 6.74 | 7.75 | 8.73 | 9.70 | 10.70 | 12.52 | |
依据上表数据或滴定曲线可得出:①CH3COOH是 (填“强”、“弱”或“非” )电解质。②在接近滴定终点(PH为7)时,一滴(约0.04mL)NaOH溶液就引起了溶液PH从 到 的突变,此种情况下选用 作为指示剂效果好。
四、(本大题共2小题,只选做一题,各10分)
27、(10分)工业上合成氨的化学反应 N2(g)+ 3H2(g)![]() 2NH3(g)
2NH3(g)
△H = - 46.2KJ·mol-1、 △S = -198.3J·mol-1·K-1,且△G =△H—T △S。在容积为10L的密闭容器中,通入40mol N2和120mol H2在一定条件下进行反应,4S后达到平衡状态,此时N2的浓度为2mol/L。通过计算回答下列问题:
⑴ 在温度为500K时,该反应 (填“能”或“不能”)自发进行。反应进行到平衡状态时△G = 。
⑵ 用N2 表示的4S内化学反应的平均速率是 。
⑶ 在该条件下N2 的最大转化率是 ;此时混合气体中NH3
的体积分数是 。
⑷ 为了提高氨气的产率,可以选择的方法是 (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
28、(10分)下图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。电极f的名称是 。
(2)滤纸B上C点的电极反应式
 为:
,
为:
,
滤纸B上发生的总反应方程式
为: 。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上的电极反应式为:
电解槽中盛放的电镀液可以是
或 (只要求填两种电解质溶液)。
四、(本大题共2小题,只选做一题,各7分)
29、(7分)已知H2的燃烧热为-285.8kJ/mol,CO的燃烧热为-283.0kJ/mol,甲醇(CH3OH)的燃烧热为-726.5kJ/mol 。请通过计算写出由CO和H2合成甲醇的热化学方程式。
30、(7分)在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得 c(H2) = 0.0080mol/L 。
(1)(3分)求该反应的平衡常数。
(2)(3分)在上述温度下,该容器中若通入H2和I2各1.0mol 的气态混合物,试求达到化学平衡状态时各物质的浓度。
(3)(1分)利用本题数据,请你说出关于化学反应速率或化学平衡的一点与数据有关的结论。
高二年级化学科《化学反应原理》模块学分认定试题参考答案
一、选择题(共82分)
1、B 2、A 3、C 4、D 5、C 6、C 7、D 8、A 9、B 10、D
11、CD 12、AC 13、C 14、A 15、B 16、D 17、AB 18、CD
19、A 20、B 21、AB 22、D 23、AD 24、BC
三、(本大题包括2个小题,共27分)
![]() 25、(共7分)Fe3+ + 3H2O
Fe(OH)3 + 3H+ (2分)
25、(共7分)Fe3+ + 3H2O
Fe(OH)3 + 3H+ (2分)
抑制氯化铁的水解 (1分)
CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ (2分)
CaCO3与上述水解平衡中的H+反应,使c(H+)减小,引起水解平衡向右移动(1分),导致Fe(OH)3增多,形成红褐色沉淀。(1分)
26、(14分)G→A→C→B→D→F→E (2分)
(2)酸式滴定管(1分)。(3)酚酞或甲基橙。锥形瓶中溶液颜色的变化;溶液由无色刚变成红色;(或溶液由红色刚变成橙色)。 (共3分)
(4)高(1分) (5) 0.25M(V2- V1)(2分)
(6).绘曲线(2分);弱(1分) 7.75—9.70 (1分);酚酞(1分)
四、(本大题共2小题,只选做一题,各10分)
27、(1)能;0 (2分)(2) 0.5 mol·L-1·S-1 (2分)
(3)50% (2分); 33.3% (2分) (4) ② ④ (2分)
28、(方程式各2分,其余各1分)
(1)正;阴极(2分)
![]() (2)2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑
(2)2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑
(3) 2 H+ + 2e - = H2↑ Zn – 2e - = Zn2+ ,
ZnSO4溶液或ZnCl2溶液。
五、(本大题共2小题,只选做一题,各7分)
29、(7分) CO(g) + 2 H2(g)
= CH3OH(l) ![]() /mol;
/mol;
(依步骤给分,共7分)
30、(共7分)
解:(1)根据题意知:
H2(g) + I2(g) ![]() 2HI(g)
2HI(g)
起始时各物质的浓度mol/L 0.010 0.010 0
变化的各物质的浓度mol/L 0.0020 0.0020 0.0040
平衡时各物质的浓度mol/L 0.0080 0.0080 0.0040
![]()
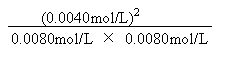
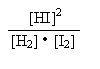 2分
2分
K =
=
= 0.25![]() 1分
1分
(2)设转化了xmol/L的H2,依据题意知:
H2(g) + I2(g) ![]() 2HI(g)
2HI(g)
起始时各物质的浓度mol/L 0.020 0.020 0
变化的各物质的浓度mol/L x x 2x
平衡时各物质的浓度mol/L 0.10-x 0.10-x 2x
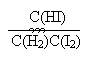
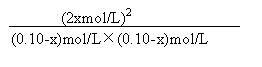
![]() 1分
1分
K =
=
= 0.25![]() 1分
1分
解得x = 0.020mol/L
平衡时C(H2)= C(I2)= 0.080mol/L C(HI) = 0.040mol/L 1分
(3)答案可以是:①①增大反应物的浓度,正反应速率增大,化学平衡向正反应方向移动。②在恒温下的等体积反应中,保持相当于各反应物的物质的量比值不变,那么新的平衡与原平衡是等效平衡。※其它的与本题数据有关的正确说法都给1分。