高二年级化学第一学期期中考试
化 学 试 卷
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),共150分,答题时间120分钟。
可能用到的原子量:H—1;O—16;S—32;Na—23;Ba—137
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
1、为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A、乙醇汽油是一种清洁能源,燃烧不会产生污染
B、乙醇与汽油组成元素相同,化学成分相似
C、乙醇汽油燃烧时,耗氧量高于等质量的汽油
D、乙醇可通过淀粉转化制得,是一种可再生的燃料
2、下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨);ΔH=+119KJ/mol 可知,石墨比金刚石稳定
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=—53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
3、碳铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法中正确的是
A、碳铵分解是因为生成了易挥发的气体,使体系的熵值增大
B、碳铵分解是吸热反应,根据能量判据不能自发分解
C、碳铵分解是因为外界给予了能量
D、碳酸盐都不稳定,都能自发分解
4、下列溶液的PH一定小于7的是
A、常温下,使PH试纸显深蓝色的溶液
B、水电离出的c(OH—)=1×10—10mol/L的溶液
C、100℃时的氯化钠溶液
D、c(H+)=1×10—3mol/L的酸和c(OH—)=1×10—3mol/L的碱等体积的混合溶液
5、一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2![]() N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
A、减少 B、增大 C、不变 D、无法判断变化情况
6、在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
A、平衡向正反应方向移动了 B、平衡向逆反应方向移动了
C、物质B的质量分数增加了 D、a<b
7、在一定条件下发生化学反应:2SO2(g)+O2(g) ![]() 2SO3(g);△H=—197kJ/mol,现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H=—197kJ/mol,现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是
A、在上述条件下反应生成1molSO3气体放热98.5 kJ
B、上述条件下每摩尔该反应进行到底时放出的热量为197 kJ
C、Q1=2Q2=2Q3=197 kJ
D、2Q2=2Q3<Q1<197kJ
8、已知有下列反应:N2O5(g)![]() N2O3(g)+O2(g);N2O3(g)
N2O3(g)+O2(g);N2O3(g)![]() N2O(g)+O2(g),在1L密闭容器中加入4molN2O5,加热到t℃时,达到平衡,O2的平衡浓度为4.5mol/L,N2O3的平衡浓度为1.62mol/L,则N2O5的平衡浓度为
N2O(g)+O2(g),在1L密闭容器中加入4molN2O5,加热到t℃时,达到平衡,O2的平衡浓度为4.5mol/L,N2O3的平衡浓度为1.62mol/L,则N2O5的平衡浓度为
A、1.44mol/L B、2.38mol/L C、3.06mol/L D、0.94mol/L
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9、室温下,由水电离得到的c(H+)和c(OH—)的乘积为1×10-24的无色溶液中,可能大量共存的离子组是
A、Na+、Fe2+、Br-、Cl- B、AlO2-、K+、NH4+、Na+
C、K+、I-、NO3-、H+ D、K+、S2-、CO32-、OH-
10、硫燃烧的主要产物SO2,但也有少量的SO3生成,对于后一过程,温度的影响大于浓度的影响。若取一定量的硫在容积相同的空气和纯氧中分别燃烧,产生SO3的体积分数分别为a和b,则a和b的关系正确的是
A、a>b B、a<b C、a=b D、无法确定
11、下列有关说法不正确的是
A、催化剂的使用能降低反应所需的能量,并提高活化分子百分数
B、燃烧热是指可燃物在氧气中完全燃烧所放出的热量
C、熵变和焓变对体系影响可表示为:△G=△H—T*△S,当△H<0,△S>0时,该反应可自发进行
D、人们在洗发时,使用的护发素可起到调节头发PH值的作用
12、一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内压强比起始时增大了20%,则容器中可能发生的反应是
A、2A+B![]() 2C B、A+B
2C B、A+B![]() 2C
2C
C、2A+B![]() C D、A+B
C D、A+B![]() 3C
3C
13、25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=![]() y,则x值为
y,则x值为
A、2 B、3 C、4 D、5
14、针对反应:Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O及其相关稀溶液间的实验,下列分析正确的是(已知Na2S2O3中S的化合价有两种)
A、Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓ + H2O
 |
B、Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓ + H2O
C、在研究温度对化学反应速率影响的实验中,反应速率通常是依据氧化产物生成的快慢来确定
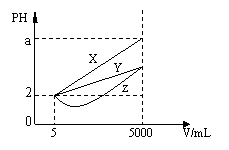 D、在研究温度对化学反应速率影响的实验中,反应速率通常是依据还原产物生成的快慢来确定
D、在研究温度对化学反应速率影响的实验中,反应速率通常是依据还原产物生成的快慢来确定
15、在一定温度下有PH均为2的X、Y、Z三种不同的
一元酸各5mL,分别加水稀释到5000mL,其pH与
溶液体积(V)的关系如图所示,下列说法正确的是
A、稀释后X溶液中水的电离程度最小
B、三种酸的原来的浓度大小为X<Y<Z
C、若X、Y、Z都是弱酸,则a的值一定小于5
D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积V(X)>V(Y)
16、有甲、乙两瓶醋酸溶液,测得甲的PH=a,乙的PH=a+1,下列推断正确的是
A、物质的量浓度C甲是C乙的10倍
B、甲溶液中c(OH—)是乙中c(OH—)的10倍
C、由水电离产生的c(H+)乙是甲的10倍
D、与等量的NaOH反应,消耗甲、乙两酸的体积V乙>10V甲
17、已知450℃时,反应H2(g)+I2(g)![]() 2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)的K=50,由此推测在450℃时,反应
2HI(g) ![]() H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A、50 B、0.02 C、100 D、无法确定
18、T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
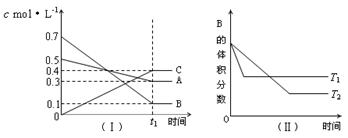
A、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B、(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C、T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C
反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
 第Ⅱ卷(非选择题,共78分)
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题,共20分)
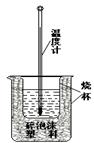
19、(8分)实验室利用如右图装置进行中和热的测定。回答下列问题:
⑴该图中有两处未画出,它们是 、 ;
⑵在操作正确的前提下提高中和热测定的准确性的关键是:
;
⑶如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出
的“中和热”将 (填“偏大”、“偏小”、“不变”);原
因是 。
20、(12分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。
如H(g)+I(g)→H-I(g),△H=—297KJ/mol即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。下表是一些键能数据(KJ·mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
回答下列问题:
⑴由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。试预测C-Br键的键能范围 。
⑵①由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=—185KJ·mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是 ;
②由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=—224.5KJ·mol-1以及表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
⑶瑞士化学家盖斯(Hess G.H)在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=—25kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=—47kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ·mol-1
①请写出CO还原FeO的热化学方程式:
;
②根据以上信息,你认为“Hess定律”在我们确定一些化学反应的反应热时有何重要意义 。
四、(本题包括2小题,共18分)
21、(8分)下列反应在210℃达到平衡:
PCl5(气) ![]() PCl3(气)+Cl2(气); △H>0 K=1
①
PCl3(气)+Cl2(气); △H>0 K=1
①
CO(气)+Cl2(气) ![]() COCl2(气);△H<0 K=5×104 ②
COCl2(气);△H<0 K=5×104 ②
COCl2(气) ![]() CO(气)+ Cl2(气);△H>0
③
CO(气)+ Cl2(气);△H>0
③
⑴根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是
A、c(PCl5)=c(PCl3)= c(Cl2) =1; B、c(PCl5)= c(PCl3)·c(Cl2)=1; C、c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式 (填“相同”或“不同”)
⑵降低Cl2浓度,反应③的K值 (填“增大”、“减少”或“不变”)
⑶要使反应①和反应②的K值相等,应采取的措施是
A、反应①、反应②同时升高温度
B、反应①、反应②同时降低温度
C、反应①降低温度, 反应②维持210℃
22、(10分)在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)==3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
⑴可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A、体系压强不再变化 B、v正(A)=2v逆(B)
C、体系的密度不再变化 D、混合气体的平均分子量不再变化
⑵如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是
A、4molA+2molB B、6molC+1molD
C、1molA+0.5molB+1.5molC+0.5molD D、2molA+1molB+3molC+1molD
E、2molA+1molB+3molC+2molD
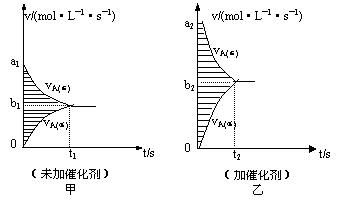
⑶若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是 (用含W的代数式表示)
⑷此反应的v—t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则其
v—t图象如乙图,请用“=、<、>”填空:①a1 a2;②b1 b2;③两图中阴影
部分面积:甲 乙。
 |
五、(本小题包括2小题,共20分)
23、(10分)常温下,PH=2的高碘酸(HIO4)溶液与PH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与PH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
⑴高碘酸是 (填“强酸或弱酸”),理由是 ;
⑵0.01mol/L的碘酸(HIO3)溶液与PH=12的NaOH溶液等体积混合所得溶液中IO3—与Na+的浓度关系是 (填“大于、小于或等于”)。
⑶已知高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,此反应中的还原剂是 ,
(写化学式),该反应的离子方程式为 。
24、(10分)工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。启东市近期一次的“空气质量日报”显示,启东的空气已受到一定程度的污染。一研究性学习小组对启东市的空气污染情况进行了下列研究。
⑴小组一同学初步分析得出,启东市空气污染的主要原因可能有如下三种:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成启东市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
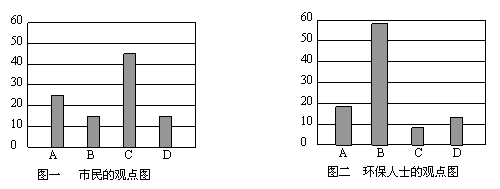 空气污染原因调查人数分布图
空气污染原因调查人数分布图
从市民和环保人士的不同观点上分析,你认为造成启东市空气污染的主要有害成分是
(用化学式表示)
⑵空气污染形成酸雨。研究性学习小组对启东市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是 ,通过计算得到的结论是 (以定量描述)
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是 (填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
六、(本小题包括2小题,共20分)
25、(10分)由HCl、MgCl2、AlCl3组成的混合溶液1.0L,其中c(HCl)=0.1mol/L,c(MgCl2)=0.1mol/L,c(AlCl3)=1.2mol/L。
⑴已知溶液中与溶液的PH的关系为lgc(Mg2+)=17—2×PH,向混合溶液中加入NaOH固体至PH=9,是否有Mg(OH)2沉淀生成? (填“是或否”)(不考虑NaOH的加入引起的体积变化,下同),原因是
⑵向混合溶液中加入NaOH固体,溶液中c(AlO2—)随PH的变化如下:
| PH | 8 | 9 | 10 | 11 |
| c(AlO2—)/mol·L—1 | 10—3 | 10—2 | 10—1 | 1 |
试写出在碱性条件下,c(AlO2—)与PH的关系式:
⑶向混合溶液中加入NaOH固体至PH=11,需要NaOH的质量为多少?(当溶液中某离子的浓度≤1×10—5mol/L时,可视为该离子完全沉淀。)(写出计算过程)。
 |
26、(10分)向一定压的仪器中充入4LN2和H2的混合气体,反应后恢复
到原温度,体积变为3.4L,容器内气体对相同条件下H2的相对密度为5。
⑴反应达到平衡时V(NH3)= L,
反应前V(N2):V(H2)= ,N2的转化率为 。
⑵向平衡后的容器中再充入0.2molNH3,再达到平衡,测得吸收了6.44kJ的热量。
①从开始到重新平衡,混合气体对H2的相对密度变化为 ;
A、先增大后变小 B、先减小后增大 C、一直减小 D、一直不变
②写出合成氨的热化学方程式:
化学试题参考答案
一、二、选择题(共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | D | D | A | C | B | B | C | D | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | B | B | CD | B | BC | BC | CD | B | BC |
三、(本题包括2小题,共20分)
19、⑴环形玻璃棒 烧杯上方的泡沫塑料盖或硬纸板(各1分); ⑵提高装置的保温效果或尽量减少热量损失;(2分)⑶偏大 (2分) 固体NaOH溶于水放热(2分)
20、⑴①不能 (1分) ②不能 (1分),218~330 KJ·mol-1(1分)
⑵①化学反应的反应热等于生成物的键能之和与反应物的键能之和的差 (2分)
②吸收(1分) 4.5(2分)
⑶①FeO(s)+CO(g)=Fe(s)+CO2(g); ΔH=-11 kJ·mol-1(2分)
②对于一些很难用实验方法直接测定热量的化学反应可用“Hess定律”间接测定。(2分)
四、(本题包括2小题,共18分)
21、⑴C 不同 ⑵不变 ⑶a (每空2分)
22、⑴BCD;⑵ADE;⑶n>![]() ;⑷<、<、=。(⑴⑵问各2分,⑶⑷问各3分)
;⑷<、<、=。(⑴⑵问各2分,⑶⑷问各3分)
五、(本题包括2小题,共18分)
23、⑴弱酸;PH=2的高碘酸电离出的c(H+)和PH=12NaOH溶液电离出的c(OH—)相等,且两者体积相等,但溶液显酸性,则高碘酸必定是不完全电离,所以高碘酸是弱酸。(其他合理答案也给分,)
⑵等于)
⑶MnSO4(1分);2Mn2+ + 5HIO4 + 3H2O== 2MnO4— + 5IO3—+ 11H+(每空2分)
24、⑴机动车尾气污染; SO2(各1分)
⑵雨水中的H2SO3逐渐被空气中的氧气氧化成H2SO4(2分)
⑶测定空气中二氧化硫的体积分数(2分);空气中二氧化硫的体积分数为2.24%(2分)
⑷①②④ (2分)
六、(本题包括2小题,共18分)
25、⑴否(1分);
当PH=9时代入,c(Mg2+)=0.1mol/L,浓度未变,则未形成Mg(OH)2沉淀。(2分)
⑵ —lgc(AlO2—)+PH=11(3分)
⑶196g(3分)
26、⑴0.6L;1:3;30%;⑵①A;②N2(g)+3H2(g)![]() 2NH3(g)△H=—92kJ/mol(每空2分)
2NH3(g)△H=—92kJ/mol(每空2分)