高二年级化学第一学期期中考试试题
第Ⅰ卷(选择题共57分)
一、选择题(本大题共19小题,每小题3分,共计57分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1、下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)=CO2(g);△H1 C(s)+![]() O2(g)=CO(g);△H2
O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=; SO2(g)△H4
③H2(g)+![]() O2(g)=H2O(1);△H5 2H2(g)+O2(g)=2H2O(1);△H6
O2(g)=H2O(1);△H5 2H2(g)+O2(g)=2H2O(1);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(1)=Ca(OH)2(s);△H8
A、① B、④ C、②③④ D、①②③
2、已知反应: ①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221 KJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(1); △H=-57.3KJ·mol-1
下列结论正确的是 ( )
A、碳的燃烧热大于110.5 KJ·mol-1(已知:燃烧热是1mol可燃物在常温常压下充分燃烧生成稳定化合物放出的热。)
B、①的反应热为221 KJ·mol-1
C、稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D、稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量
3、已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨,s)+O2(g)=CO2(g); △H=-393.51 KJ·mol-1
C(金刚石,s)+O2(g)=CO2(g); △H=-395.41 KJ·mol-1
据此判断,下列说法正确的是( )
A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚的高
4、已知反应A2(g)+2B2(g) ![]() 2AB2(g)△H<0,下列说法正确的是(
)
2AB2(g)△H<0,下列说法正确的是(
)
A、升高温度,正向反应速率增加,逆向反应速率减小
B、升高温度有利于反应速率增加,从而缩短达到平衡的时间
C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
5、对可逆反应4NH3(g)+5O2(g)
![]() 4NO(g)+6H2O(g),下列叙述正确的是 ( )
4NO(g)+6H2O(g),下列叙述正确的是 ( )
A、达到化学平衡时,4![]() (O2)=5
(O2)=5![]() (NO)
(NO)
B、若单位时间内生成x mol NO 的同时,消耗x mol NH3,则反应达到平衡状态
C、达到化学平衡时,若增加容器容积,则正反应速率减小,逆反应速率增大
D、化学反应速率关系是:2![]() (NH3)=3
(NH3)=3![]() (H2O)
(H2O)
6、将4 mol A 气体和2 mol B 气体在2 L 的容器中混合并在一定条件下发生如下反应2A(g)+B(g)![]() 2C(g),若经2 s 后测得C的浓度为0.6 mol·L-1,现在下列几种说法,其中正确的是( )
2C(g),若经2 s 后测得C的浓度为0.6 mol·L-1,现在下列几种说法,其中正确的是( )
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70% ④2s 时物质B的浓度为0.7 mol·L-1
A、①③ B、①④ C、②③ D、③④
7、设C+CO2![]() 2CO;△H>0,反应速率为υ1;N2+3H2
2CO;△H>0,反应速率为υ1;N2+3H2![]() 2NH3;△H<0,反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为( )
2NH3;△H<0,反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为( )
A、同时增大 B、同时减小 C、υ1增大,υ2减小 D、υ1减小,υ2增大
8、在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是 ( )
A、加入水时,平衡向逆反应方向移动
B、加入少量NaOH固体,平衡向正反应方向移动
C、加入少量0.1 mol·L-1HC1溶液,溶液中c(H+)减小
D、加入少量CH3COONa固体,平衡向正反应方向移动
9、某温度下,容积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) ![]() Z(g)+W(s);△H>0。下列叙述正确的是(
)
Z(g)+W(s);△H>0。下列叙述正确的是(
)
A、加入少量W,逆反应速率增大
B、当容器中气体压强不变时,反应达到平衡
C、升高温度,平衡逆向移动 D、平衡后加入X,上述反应的△H增大
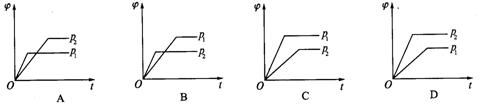
10、在一定温度不同压强(p1<p2)下,可逆反应2X(g)![]() 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是( )
)与反应时间(t)的关系有以下图示,正确的是( )
 |
![]()
|
![]() Ni(s)+4CO(g)
Ni(CO)4(g)
Ni(s)+4CO(g)
Ni(CO)4(g)
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是( )
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
12、某温度下在密闭容器中发生如下反应:2M(g)+N(g) ![]() 2E(g) 若开始时只充入2
mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2
mol M 和 1 mol N 的混合气体,达平衡时M的转化率为( )
2E(g) 若开始时只充入2
mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2
mol M 和 1 mol N 的混合气体,达平衡时M的转化率为( )
A、20% B、40% C、60% D、80%
13、对已达化学平衡的下列反应2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生的影响是( )
2Z(g)减小压强时,对反应产生的影响是( )
A、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B、逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C、正、逆反应速率都减小,平衡向逆反应方向移动
|
![]() 14、对于反应2SO2+O2
2SO3,下列判断正确的是
(
)
14、对于反应2SO2+O2
2SO3,下列判断正确的是
(
)
A、2体积SO2和足量O2反应,必定生成2体积SO3
B、其他条件不变,增大压强,平衡必定向左移动
C、平衡时,SO2消耗速率必定等于O2生成速率的两倍
D、平衡时,SO2深度必定等于O2深度的两倍
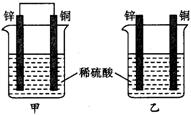 15、将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
(
)
15、将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
(
)
A、两烧杯中铜片表面均无气泡产生
B、甲中铜片是正极,乙中铜片是负极
C、两烧杯中溶液的pH均增大
D、产生气泡的速度甲比乙慢
16、关于电解NaC1水溶液,下列叙述正确的是( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
17、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知:氧化性Fe2+<Ni2+<Cu2)
A、阳极发生还原反应,其电极反应式:Ni2++2e— === Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
18、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
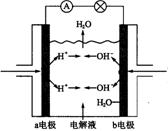 A、a电极是负极
A、a电极是负极
B、b电极的电极反应为:4OH— —4e—==2H2O+O2↑
C、氢氧燃料电池是一种具有应用前景的绿色电源
D、氢氧燃料电池是一种不需要将还原剂和氧化剂
全部储藏在电池内的新型发电装置
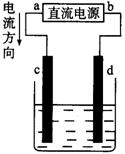 19、右图是电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
19、右图是电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极,b为正极
B、a为阳极,b为阴极
C、电解过程中,d 电极质量增加
D、电解过程中,氯离子浓度不变
第Ⅱ卷(非选择题,共43分)
二、填空题(本题包括5个小题,共43分。把答案填在题中横线上)
20、(8分)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H—T△S=0。当体系温度低于980K时,估计,△H—T△S的正负符号为 ;当体系温度高于980K时,△H—T△S的正负符号为 。在冶金工业中,以C作为还原剂温度高于980K时的氧化产物是以 为主,低于980K时以 为主。
CO2(g)+C(s),T=980K时,△H—T△S=0。当体系温度低于980K时,估计,△H—T△S的正负符号为 ;当体系温度高于980K时,△H—T△S的正负符号为 。在冶金工业中,以C作为还原剂温度高于980K时的氧化产物是以 为主,低于980K时以 为主。
21、(8分)反应:N2(g)+3H2(g)![]() 2NH3(g)在恒温恒容条件下进行,下列情况中,反应正向进行的是 ;反应逆向进行的是
;处于平衡状态的是 ;无法判断是否达到平衡的是
。
2NH3(g)在恒温恒容条件下进行,下列情况中,反应正向进行的是 ;反应逆向进行的是
;处于平衡状态的是 ;无法判断是否达到平衡的是
。
A.单位时间内消耗2mol N2,同时生成4mol NH3
B.单位时间内消耗3mol H2,同时生成2mol NH3
C.单位时间内消耗2mol N2,同时生成6mol N—H键
D.混合气的密度不再随时间而改变
E.容器中气体的压强不再随时间而改变
F.单位时间内生成2mol NH3,同时又形成2mol H—H键
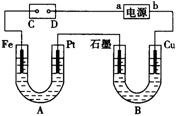 22、(7分)电解装置如图所示。图中B装置盛1 L 2mol·L-1的Na2SO4溶液,A装置中盛1 L 2mol·L-1 AgNO3溶液。通电后,润湿的淀粉KI 试纸的C端变蓝色。电解一段时间后,试回答:
22、(7分)电解装置如图所示。图中B装置盛1 L 2mol·L-1的Na2SO4溶液,A装置中盛1 L 2mol·L-1 AgNO3溶液。通电后,润湿的淀粉KI 试纸的C端变蓝色。电解一段时间后,试回答:
(1)A中发生反应的化学方程式为:
。
(2)在B中观察到的现象是
。
| 座号 |
(3)室温下若从开始到时间为t时,A、B装置中共收集到0.168L(标准状况)气体。若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液的pH为 。
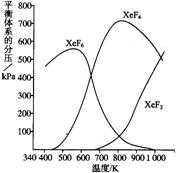 23、(10分)在密闭容器中,由一定起始深度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
23、(10分)在密闭容器中,由一定起始深度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
(1)420K时,发生反应的化学方程式为:
;
若反应中消耗1 mol Xe , 则转移电子 mol 。
(2)600~800K时,会发生反应:
XeF6(g) ![]() XeF4(g)+F2(g),其反应热△H
0
XeF4(g)+F2(g),其反应热△H
0
(填“>”“<”或“=”)。理由是
。
(3)900K时,容器中存在的组分有 。
24、(10分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾溶液反应的离子方程式是 。
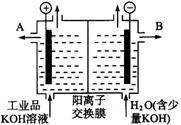 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
①该电解槽的阳极反应式是
。
②通电开始后,阴极附近溶液pH会增大,
请简述原因
。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
高二年级化学期中考试试题答案
一、
1—5 CAABA 6—10 BABBB
11—15 BCCCC 16-19 BDBC
二、
20、(8分)负、正、CO、CO2
21、(8分)F、C、E、ABD
22、(7分)
⑴4AgNO3+2H2O通电4Ag+O2↑+4HNO3
⑵接通电源后,铜棒周围开始变蓝色,石墨棒上有无色气泡产生,一段时间后,U形管底部出现蓝色絮状沉淀
⑶2
23、(10分)
⑴Xe+3F2===XeF6 6
⑵> 随着温度的升高,XeF6(g) ![]() XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0
XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0
⑶XeF6、 XeF4 、XeF2 、Xe、F2
24、(10分)
⑴Al2O5(熔融)通电4Al+3O2↑
⑵2Al+2OH—+2H2O===2AlO2—+3H2↑
⑶ ①4OH——4e—===2H2O+O2↑
②H+放电,促进水的电离,OH—浓度增大
③B