高二化学第二学期期中考试试卷(选修)
命题:蔡 英 审核:沈毅迅
考试时间:120分钟
可能用到的相对原子质量H-1、C-12、O-16、Zn-65、Cl-35.5
第I卷(选择题 共64分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1、下列有关化学反应速率的说法正确的是:( )
A、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B、2mol/ L100ml的盐酸和锌片反应,加入适量的氯化钠溶液,反应速率不变
C、SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D、汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
2、下列说法正确的是:( )
A、增大反应物浓度,能增大活化分子百分数,所以反应速率增大
B、使用催化剂,能增大活化分子数,所以反应速率增大
C、对于任何反应,增大压强都可以加快反应速率
D、升高温度,只能增大吸热反应的反应速率
3、已知反应:PC15![]() PC13 + C12,将1.0 mol PC15充入容积为2 L的密闭容器中,一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4 mol/(L·min),则这段时间为: ( )
PC13 + C12,将1.0 mol PC15充入容积为2 L的密闭容器中,一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4 mol/(L·min),则这段时间为: ( )
A、50 s B、30 s C、5 s D、1 s
4、下列有关化学反应的说法正确的是:( )
A、自发反应都是放热反应
B、自发反应都是熵增大反应
C、非自发反应在一定条件下能实现
D、自发反应都是吸热反应
5、在某温度下,可逆反应mA + nB ![]() pC + qD的平衡常数为K,下列说法正确的是:( )
pC + qD的平衡常数为K,下列说法正确的是:( )
A、K越大,达到平衡时,反应进行的程度越大
B、K越小,达到平衡时,反应物的转化率越大
C、K随反应物浓度的改变而改变
D、K随温度和压强的改变而改变
6、可逆反应:2NO2 ![]() 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是:
( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是:
( )
①单位时间内生成n molO2的同时生成2 nmolNO2 ②单位时间内生成n molO2的同时生成2 nmolNO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A、①④⑥ B、②③⑤ C、①③④ D、①②③④⑤⑥
7、pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+)为(mol/L):( )
A、(4×10-9 + 1×10-12) 1/5 B、 (8×10-9 + 1×10-12) 1/5
C、5×10-10 D、5×10-12
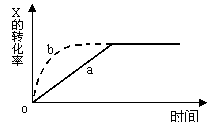
8、下图曲线a表示放热反应 X(g) + Y(g) ![]() Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线(图中虚线)进行,可采取的措施是 :
( )
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线(图中虚线)进行,可采取的措施是 :
( )
A、升高温度 B、加大X的投入量 C、加催化剂 D、增大体积
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一至两个选项符合题意)
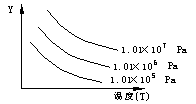
![]() 9、下图表示外界条件(温度、压力)的变化对下列反应的影响L(s)+G(g) 2R(g) (正反应吸热) 在图中Y轴是指:(
)
9、下图表示外界条件(温度、压力)的变化对下列反应的影响L(s)+G(g) 2R(g) (正反应吸热) 在图中Y轴是指:(
)
A、平衡混合气中R的质量分数 B、平衡混合气中G的体积分数
C、G的转化率 D、L的转化率
 |
10、下列有关叙述中正确的是:( )
A、难溶于水的电解质一定是弱电解质
B、强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C、易溶于水的电解质一定是强电解质
D、强电解质在水溶液中的电离过程是不可逆的
11、在某温度下,NaCl稀溶液中c(H+)为1×10-6mol/L。下列说法中正确的是: ( )
A、该NaCl溶液显酸性 B、该NaCl溶液显中性
C、该NaCl溶液中Kw=1×10-14 D、该NaCl溶液中Kw=1×10-12
12、用pH试纸测某溶液的pH时,规范的操作是:( )
A、将pH试纸放入溶液,观察其颜色变化,跟标准比色卡比较
B、用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
C、用蒸馏水湿润pH试纸,用玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D、在试管内放入少量溶液煮沸,把pH试纸放在试管口上观察,跟标准比色卡比较
![]() 13、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反N2(g)+3H2(g)
13、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反N2(g)+3H2(g)
2NH3(g) ,673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是:( )
A、点a的正反应速率比点b的大
B、点 c处反应达到平衡
C、点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
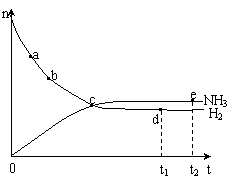 D、点d:v正(H2)=3v逆(N2)
D、点d:v正(H2)=3v逆(N2)
14、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两处溶液的体积和CH+都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是: ( )
A、 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B、 甲烧杯中的酸过量
C、两烧杯中参加反应的锌等量
D、反应开始后乙烧杯中的CH+始终比甲烧杯中CH+小
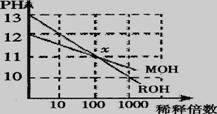
15、MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是:( )
A、ROH是一种强碱 B、在x点,MOH完全电离
C、在x点,c(M+)=c(R+) D、稀释前,c(ROH)=10c(MOH)
![]() 16、在一固定体积的密闭容器中,加入2molA和2molB,发生反应如下:2 A(g)+2B(g) 3C(g)+D(g)当反应达到平衡时,C的浓度为Wmol/L若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是:( ) (
)
16、在一固定体积的密闭容器中,加入2molA和2molB,发生反应如下:2 A(g)+2B(g) 3C(g)+D(g)当反应达到平衡时,C的浓度为Wmol/L若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是:( ) (
)
A、4molA+4molB B、2molA+2molB+6molC+2molD
C、3molA+1molB+1molC D、3molC+1molD
17、α1和α2分别为A、B在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是:( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是:( )
A、α1、α2均减小 B、α1、α2均增大
C、α1减小,α2增大 D、α1增大,α2减小
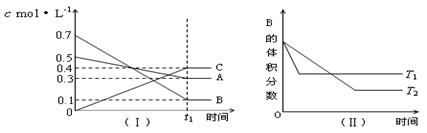
18、T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是:( )
A、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B、(t1+10)min时,保持容器总体积不变,通入稀有气体,平衡向正反应方向移动
C、T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1。
D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
 |
高二化学期中考试试卷(选修)(答案纸)
选择题答案栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷(非选择题 共56分)
三、(本题包括2小题,共12分)
19、⑴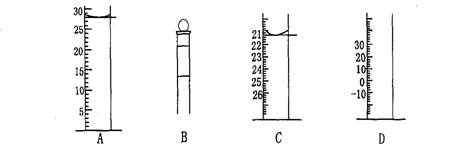 下图为常见仪器的部分结构(有的仪器被放大)
下图为常见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
⑵、有一支50ml酸式滴定管,其中盛有溶液,液面恰好在10.00ml刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积: ( )
A、大于40.00ml B、为40.00ml C、小于40.00ml D、为10.00ml
⑶、某同学的实验报告中有如下数据,其中数据合理的是:
A、用托盘天平称取3.25gNaCl B、用酸式滴定管量取20.00mLKMnO4溶液
C、用量筒量取5.26mL盐酸 D、用容量瓶配制216mL0.1mol/L的NaOH溶液
E、用广泛pH试纸测得某酸溶液的pH值是3.3
20、1923年化学家Bronsted和Lowry提出.凡是能给出质子的物质都是酸,凡是能接受质子的物质都是碱。按此理论,下列粒子.①HS-; ②NH4+; ③HCl; ④OH-;⑤H2PO4-; ⑥H2S; ⑦CH3COO-; ⑧CO32-; ⑨HCO3-; ⑩H2O 中属于两性物质的有 (填编号)
四、(本题包括3小题,共21分)
21、可逆反应:aA(g)
+ bB(g)![]() cC(g)
+ dD(g);ΔH=Q
cC(g)
+ dD(g);ΔH=Q
根据图回答:① 压强 P1比P2 填(大或小)
② (a +b)比(c +d) 填(大或小)
③ 温度t1℃比t2℃ 填(高或低)
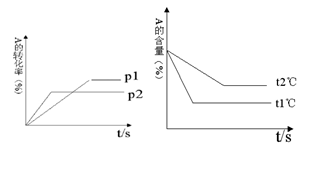 ④ Q值为 填(正或负)(正值表示正反应吸热,负值表示正反应放热)
④ Q值为 填(正或负)(正值表示正反应吸热,负值表示正反应放热)
22、一定条件下反应A(气)+B(气)![]() C(气); △H<0达到平衡后,据下列图象判断:
C(气); △H<0达到平衡后,据下列图象判断:
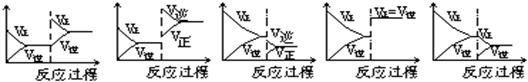 |
A B C D E
A B C D E
⑴增加A的量,移向新平衡的是: ,⑵升温,达到新的平衡的是:
⑶降压,达到新的平衡的是: ,⑷使用催化剂,达到平衡的是:
⑸减少C的量,移向新平衡的是:
23、某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;②Te和H2不能直接化合生成H2Te;氧气、硫、硒、碲与1mol H2反应的焓变情况如下表所示。
| 物质 | O2 | S | Se | Te |
| △H(kJ·mol-1) | -242 | -20 | 81 |
|
请回答下列问题:
(1)写出氧族元素中含有的18个电子的两种氢化物的化学式 、 。
(2)写出生成硒化氢的热化学方程式 。
(3)已知298K时,H2Te分解反应的△S>0,△H=-154kj·mol-1,请解释Te和H2不能直接化合的原因
五、(本题包括2小题,共16分)
24、有浓度均为0.1mol/L-1 的盐酸、硫酸、醋酸三种溶液:
(1)若三种溶液c(H+)依次为a1、a2、a3 mol/L 则他们的大小关系是_________
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,若生成盐的物质的量依次为b1、b2、b3mol,则他们的大小关系是_________
(3)分别用以上三种酸中和等物质的量浓度等体积的NaOH溶液并生成正盐,若需酸溶液的体积依次为V1、V2、V3L,则其大小关系为_________
(4)分别与锌反应,开始时产生H2 的速率为v1、v2、v3,则其大小关系是_________
25、在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)![]() 3Z(气). 已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(气). 已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol 的Y, 加入 mol 的Z,才能使平衡时Z为0.9a mol。
六、(本题包括1小题,共7分)
![]() 26、对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,求:
26、对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,求:
(1) x的值是多少? (2) L的转化率是多少? (3) M的反应速率![]() 是多少?
是多少?