高二化学第二学期期中考试试卷
注意:试卷总分值:120,考试时间:100分钟。
可能用到的原子量:C—12 O—16 Cu—64 Ag—108
第Ⅰ卷 (选择题 共56分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确答案)
1. 下列说法中,正确的是( )
A.有机物是从动植物体中提取的有生命的化合物
B.组成有机物的元素除碳外,通常还有氢、氧、氮、磷、硫、卤素等
C.人们只能从有机体中取得有机化合物,不能利用矿物来合成
D.聚氯乙烯保鲜膜最适合用来包装蔬菜、水果及熟食
2. 一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2+ + Cu,该反应的原电池的组成正确的是( )。
| A | B | C | D | |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2S04 | CuSO4 | FeCl2 |
3. 埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是( )
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松的碱性土壤中
C.在含碳粒较多,潮湿透气的中性土壤中
D.在干燥致密不透气的土壤中
4.在原电池和电解池的电极上所发生的反应,属于氧化反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
5. 根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;
③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e-=W,Y-2e-=Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
6.下列描述中,不符合生产实际的是( )
A.电解熔融的氯化钠制取金属钠,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
7. 氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池反应,下列氧化还原反应,在一定的条件下不能设计成原电池反应的是( )
A. Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
B. 2Fe+O2+2H2O=2Fe(OH)2
C. Zn+Ag2O+H2O=Zn(OH)2+2Ag
D. 2FeCl2+Cl2=2FeCl3
8. pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
A. H2SO4 B. NaOH C.AgNO3 D.Na2SO4
二、选择题(本题包括8小题,每小题4分,共32分,每小题有1-2个正确答案)
9. 下列变化中属于原电池反应的是( )
A.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
B.在空气中金属铝表面迅速被氧化形成保护膜
C.红热的铁丝与水接触表面形成蓝色保护层
D.在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生
10. 实验室准备较快地制取氢气,可采用的方法是( )
A.用纯锌与稀硫酸反应 B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反 D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应。
11. 以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
A.3mol B.4mol C.5mol D.6mol
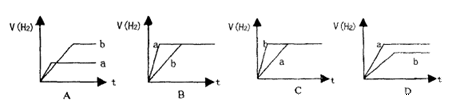 12.将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是 ( )
12.将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是 ( )
13. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
14. 以石墨做电极电解200mL 0.5mol/L的硫酸铜溶液,在标准状况下,阴极上收集到2.24L气体时,停止通电。此时欲使溶液恢复到电解前溶液的组成和浓度,可加入适量的( )
A.H2O B. CuO C. Cu(OH)2 D.CuO和H2O
|
15. 柯尔贝反应是:2RCOOK+2H2O——→ R-R+2CO2+H2+2KOH(式中“R-”代表烃基)。下列说法正确的是 ( )
A.含碳元素的产物均在阴极区生成
B.含碳元素的产物均在阳极区生成
C.含氢元素的产物均在阳极区生成
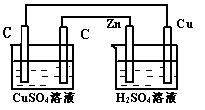 D.CO2在阴极逸出,H2在阳极逸出
D.CO2在阴极逸出,H2在阳极逸出
|
|
A.相同条件下,两容器中产生气体体积相同
B.①、②溶液的pH均减小
C.①中阳极电极反应式为:4OH一一4e一= 2H2O+O2↑
D.①中阴极上析出0.64g铜
第Ⅱ卷 (非选择题 共64分)
三、填空题(本题共5小题,共43分)
17.(8分)锌-锰干电池是普遍使用的化学电池,其中含有MnO2、NH4Cl、ZnCl2等糊状物。以锌筒为负极材料,石墨为正极材料。工作时反应方程式是:
Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:
正极:_________________________负极:______________________
干电池用久了就会变软,其原因是____________________________。
(2)正极反应中,前后经历下列反应:2NH4++2e-=2NH3+H2;2MnO2+H2=Mn2O3+H2O,如果没有MnO2参与,干电池将难于持续稳定工作。
试说明理由:_______________________________________________。
18.(9分)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
(1)该电池反应的总离子方程式为_______________________。
(2)甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,则转移的电子物质的量为________。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为_________________________________________。
②放电时固体电解质里的O2-离子的移动方向是向_____极移动(填正或负)。
19.(8分)以A、B两根石墨棒作电极,电解硝酸银溶液,通电10分钟时,在B极收集到气体11.2毫升(标况);然后将电源反接,以相同的电流强度再通电5分钟,此时与第一次通电前相比较,两极的质量变化分别是A极__________、 B极________(填增大、减少、不变) ,其数值分别是A_________ 、 B________ ;
若溶液的体积为200毫升(设体积不变),则溶液的pH值为__________。
20. (10分)已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,正极 。若不能后面两空不填。
 (3)若电池反应为:Cu+2H+= Cu2++H2,该电池属于原电池还是电解池?请写出电极材料和电解质溶液。
(3)若电池反应为:Cu+2H+= Cu2++H2,该电池属于原电池还是电解池?请写出电极材料和电解质溶液。
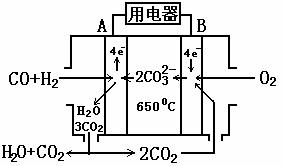
21.(8分)熔融碳酸盐燃料电池(MCFS),发明于1889年,上世纪的30~60年代在荷兰得到广泛的发展,而且建成了寿命超过40000小时的电池,可应用于中心电站。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2)直接作燃料,其工作原理如图所示。请回答下列问题:
(1)B极为 极,发生 (填“氧化”或“还原”)反应,该极发生的电极反应为 ;
(2)电池总反应为_________________________ 。
四、实验题(共10分)
22.(10分)现有一个装有某种电解质溶液的烧杯,某一电池,两根石墨电极,一根锌电极,一根铁电极,一根铜电极和导线,你能选用上述仪器和药品设计一个简单实验来判断某电池的正负极吗?(电解质溶液任选)
 (1)请你画出进行该实验的装置图:
(1)请你画出进行该实验的装置图:
(2)实验现象及结论是:
。
(3)电极反应方程式:__________________________________
五、计算题(共11分)
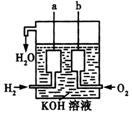
23. (11分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是__________极;b是____________极。电极反应式分别为_____________________、________________________________;
|
已知:![]() ;
;![]()
 |
(3)当这种电池使小灯泡连续发光一段时间后,耗电能为5.4KJ,则消耗标准状况下的![]() 多少升?
多少升?
高二化学试卷答题纸
选择题共56分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
三、填空题(本题共5小题,共43分)
17.(8分)
(1)
(2)
18.(9分)
(1)
(2)
(3)
19.(8分)
20. (10分)
(1)
(2)
(3)
21.(8分)
(1)
(2)
四、实验题
22.(10分)
 (1)
(1)
(2)实验现象及结论是:
。
(3)电极反应方程式:
__________________________________
五、计算题
23. (11分)
(1)
(2)
(3)
化学试卷参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| B | C | D | C | C | A | A | B | AD | B | C | A | D | CD | B | CD |
17.(1)2NH4++2MnO2+2e-=2NH3+Mn2O3+H2O Zn-2e-=Zn2+ 电池放电过程中有水产生、锌筒变薄造成干电池变软
(2)正极反应的中间产物H2附着于石墨,增加电池内阻。
18(1)、 2CH3OH+3O2+4 OH-=2CO32-+6H2O
(2)、 负 下降 3mol
(3)、① O2+4e-=2O2- ② 负
19.增大、增大、0.108g、0.108g、pH=2
20.(1)形成原电池加速铝导线的腐蚀能,
(2)Cu—2 e-= Cu2+,2Fe3+ +2 e-=2Fe2+,
(3)电解池,阳极铜,阴极碳棒,稀硫酸作电解液。
21.(1)正 还原 2CO2 + O2 + 4e- = 2CO32―
(2)CO + H2 + O2 ![]() CO2 +H2O
CO2 +H2O
22.(1)选用其它材料作电极,只要叙述合理均得分。
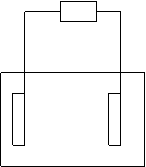
![]() 石墨
石墨
![]()
![]()
![]()
![]()
![]()
氯化铜
(2)按上图进行实验,若石墨棒上放出气泡,该石墨所连接的电源为正极,另一电极为负极。若石墨棒上生成红色固体,该石墨所连接的电源电极为负极,另一电极为正极。
(3)电极方程式:阳极 2Cl- - 2e- == Cl2 ↑
阴极 Cu2+ + 2e- == Cu
23.(11分)(1)负极;正极;负极![]() ;正极
;正极![]()
(2)试计算能量的利用率;
1度电为1 kWh,即3600kJ,由![]() ,
,![]() 可知,生成350 g液态水需能量5561 kJ,这些能量转化为3600 kJ电能,转化度为64.7%
可知,生成350 g液态水需能量5561 kJ,这些能量转化为3600 kJ电能,转化度为64.7%
(3)小灯泡发光,耗电能5.4kJ,该电能由5.4kJ/0.647=8.34kJ化学能转化而来,根据热反应式可求出需标准状况下![]()