高二化学第二次阶段性测试
高 二 化 学
命题人:孙永辉 审核人:史小兵
第Ⅰ卷(选择题,共44分)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至8页,共100分,考试用时100分钟。
考生注意:
1.答题前,考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、班级,并用铅笔正确涂写考试号,没有填写上述三项的,均直接扣除其总得分中的5分。
2.第Ⅰ卷(1~18题),由机器阅卷,答案必须全部涂写在答题卡上。考生应将代表正确答案的小方格用铅笔涂黑。注意试题题号和答题纸编号一一对应,不能错位。答案需要更改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
3.第Ⅱ卷(19~24题),该部分答案一律用钢笔或圆珠笔填写在答题纸上,用铅笔的,均直接扣除其总得分中的5分,写在试卷上一律不给分。
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Cl-35.5,Cu-64, Ca-40
P—31,Br—80,I—127
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。)
1.由于人口的增长和工业发展,废气排放量逐年增加。为了提高煤燃料的热效率并减少SO2有害物质的污染,下列采取的措施正确是
A.通入大量的空气 B.控制煤的生产
C.将煤经过脱硫处理,使之转化成气体燃料 D.将固体燃料粉碎,使之充分燃烧
2.糖类、油脂、蛋白质是人类的重要营养物质。下列说法正确的是
A.糖类是指具有一定的甜味的有机物质
B.硬脂酸甘油脂的相对分子质量为890,故其属于高分子化合物
C.所有的糖类、油脂、蛋白质在一定条件下都能发生水解反应
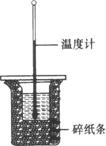
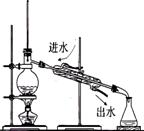
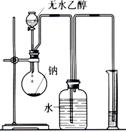
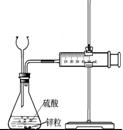
D.十个氨基酸分子之间脱去九个水分子,得到的是十肽
3.各种有机合成材料已经成为人类生活、生产和发展不可或缺的物质。下列关于材料的说法中,不正确的是
A.塑料、合成纤维和合成橡胶被称为“三大合成材料”
B.聚丙烯塑料的结构简式可表示为![]()
C.合成高分子化合物的结构可大致分为线型结构、支链型结构和网状(或体型)结构
D.聚丙烯酸钠是一种高吸水性材料,属于功能高分子材料
4.在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+725.8 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
D.CH3OH(l)+3/2O2(g) CO2(g)+2H2O(l) △H=-22.68 kJ/mol
5.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧生成相同状态下的SO2,后者放出的热量多
B.由C(金刚石,s) C(石墨,s);△H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.CaCO3(s) CaO(s)+CO2(g);△H=+178.5 kJ/mol可知,E(生成物)>E(反应物)
D.在稀溶液中H+(aq)+OH-(aq) H2O(l);△H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ
6.一定条件下的密闭容器中,进行如下反应:
NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol
N2(g)+CO2(g);ΔH=-373.2 kJ/mol
为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
A.加(正)催化剂 B.增大压强(体积减小)
C.给体系加热 D.从体系中不断移去部分CO2
7.对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
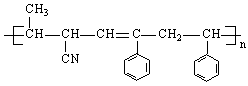 8.有4种有机物:①
8.有4种有机物:①![]() ②
②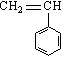 ③
③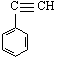 ④CH3-CH=CH-CN,
④CH3-CH=CH-CN,
其中可用于合成结构简式为 的高分子材料的正确组合为
A.①③④ B.①②③ C.①②④ D.②③④
9.一定条件下,在一恒容密闭容器中,能表示反应 X(g) + 2Y(g) ![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
① 容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.②③ C.③④ D.①④
10.一定温度下,反应2SO2+O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个该小题就为0分。)
11.下列实验的有关操作,其中正确的是
A.在溴乙烷中加入NaOH水溶液并加热,水层中加入足量HNO3酸化,再滴入AgNO3试液以检验其是否发生水解
B.向蛋白质溶液中加入CuSO4盐溶液会使蛋白质发生盐析
C.在蔗糖溶液中滴加几滴稀硫酸,微热,加新制Cu(OH)2悬浊液煮沸,通过观察有无砖红色沉淀生成检验蔗糖水解产物是否含有葡萄糖
D.要除去苯中的少量苯酚,可采用加足量NaOH溶液充分振荡,静置分液的方法
12.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式如图。下列有关咖啡酸的说法中,正确的是
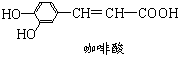 A.咖啡酸可以发生还原、取代、加聚等反应
A.咖啡酸可以发生还原、取代、加聚等反应
B.1 mol咖啡酸最多可与1 mol Br2发生反应
C.1 mol咖啡酸最多可与4 mol H2发生加成反应
D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
13.下列说法正确的是
A.能够发生化学反应的碰撞是有效碰撞
B.反应物分子的每次碰撞都能发生化学反应
C.活化分子之间的碰撞一定是有效碰撞
D.增大反应物浓度时,活化分子百分数增大
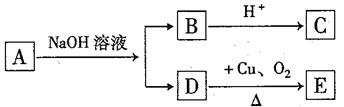 14.某有机物A的分子式为C6H12O2,已知A~E有如右图转化关系,且D不与NaHCO3溶液反应,C、E均能发生银镜反应,则A的结构可能有
14.某有机物A的分子式为C6H12O2,已知A~E有如右图转化关系,且D不与NaHCO3溶液反应,C、E均能发生银镜反应,则A的结构可能有
A.2种 B.3种
C.4种 D.5种
15.1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/mol D.+(10X-Y) kJ/mol
16.在一密闭容器中,反应m A(g)+n B(g) ![]() 3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是
A.A的质量分数增加 B.平衡不移动
C.化学计量数:m+n=3 D.物质C的体积分数减小
|
|
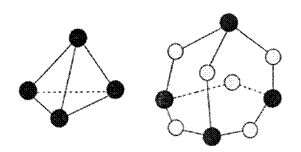 17.化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能:P—P 198kJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为:498 kJ·mol—1。
17.化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能:P—P 198kJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为:498 kJ·mol—1。
则反应P4(白磷)+3O2 P4O6的反应热△H为
A.-1638 kJ/mol B.+1638 kJ/mol
C.-126 kJ/mol D.+126 kJ/mol
18.在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
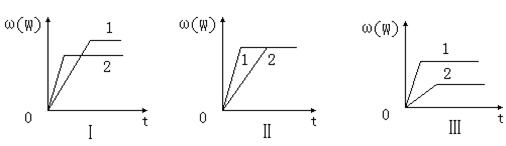
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
高 二 化 学
命题人:孙永辉 审核人:史小兵
第Ⅱ卷(非选择题,共56分)
三、(本题包括2小题,共18分)
19.(8分)下列图示的装置或操作中均有一个明显的错误,试用简短的语言更正之,将其填入对应装置下方的空格中。
| ①中和热的测定 | ②实验室蒸馏石油 | ③测定乙醇跟钠反应放出氢气体积的装置 | ④测量锌与稀硫酸反应速率的装置 |
|
|
|
|
|
20.(10分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
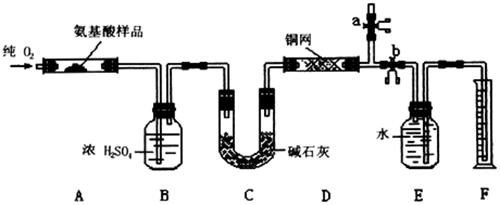
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
;之后则需关闭止水夹 ,打开止水夹 。
(2)以上装置中需要加热的有(填装置代号) 。操作时应先点燃 处的酒精灯。
(3)装置A中发生反应的化学方程式为 ;
(4)装置D的作用是 ;
(5)实验中测得N2的体积为V mL(已换算成标准状况)。为确定此氨基酸的分子式,还需得到的数据有(填字母) 。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.该氨基酸的摩尔质量
四、(本题包括2小题,共19分)
21.(7分)某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗进行综合利用,不仅可以提高经济效益,而且还能防止环境污染,现按以下方式进行:
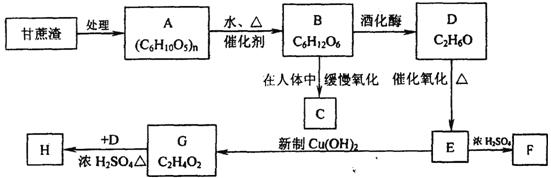
已知F、H均是具有香味的液体,F为E的三聚合物,并具有特殊的6元环状对称结构,试填空:
(1)A的名称是 ;
(2)E → G的化学方程式 ;
(3)G → H的化学方程式 ;
(4)F的结构简式: 。
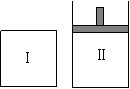 22.(12分)如右图,Ⅰ是恒温恒容密闭容器,Ⅱ是恒温恒压密闭容器。将2 mol A和2
mol B充入其中的某一密闭容器中发生反应:
22.(12分)如右图,Ⅰ是恒温恒容密闭容器,Ⅱ是恒温恒压密闭容器。将2 mol A和2
mol B充入其中的某一密闭容器中发生反应:
2A(g)+B(g) ![]() x C(g)
x C(g)
达到化学平衡后,C的体积分数为a,物质的量浓度为b mol/L。
回答下列问题:
(1)若是在Ⅰ容器中进行,当x=1时,按1 mol A、 mol B和 mol C作为起始物质,达到平衡后,C的体积分数仍为a;
(2)若是在Ⅰ容器中进行,当x=2时,2 mol B、4 mol C作起始物质,达到平衡后,C的体积分数 a(填“>”、“<”或“=”);
(3)若是在Ⅱ容器中进行,按1 mol A、1.5 mol B和2 mol C作为起始物质,达到平衡后,C的体积分数仍为a。则x= 。
(4)若是在Ⅱ容器中进行,按3 mol A、3 mol B作起始物质,达到平衡后,C的物质的量浓度 b mol/L(填“>”、“<”或“=”),理由是 。
五、(本题包括2小题,共19分)
23.(8分)某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
试求:
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
24.(11分)有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| (1)称取A 9.0 g,升温使其气化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)有机物A的相对分子质量为: 。 |
| (2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2 g,硫酸铜粉末没有变蓝,石灰水中有10.0 g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48 L无色无味气体(标准状况)。 | (2)9.0 g有机物A完全燃烧时,经计算:生成CO2共为 mol, 生成的H2O g。 (3)有机物A的分子式 。 |
| (3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (4)A的结构简式 。 |
| (4)有机物A可跟乙酸发生酯化反应,其质量比为3:2;有机物A也可跟乙醇发生酯化反应,其物质的量比为1:1;且酯化反应分别发生在链中间和链端。 | |
| (5)有机物A可否发生缩合聚合(即缩聚)反应?若能,请直接写出反应的化学方程式;若不能,请指出原因。
| |
| (6)若液态A在25℃、1.01×105 Pa下的燃烧热为-321.2 kJ·mol-1,写出液态A完全燃烧的热化学方程式:
| |
试题到此结束,请认真检查。
高二化学参考答案
一、二选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | B | A | C | D | A | D | B | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | AD | AC | A | C | B | BC | A | AC |
三、(本题包括2小题,共18分)
19.①缺环形玻璃搅拌棒;②冷凝管进出水方向弄反;③量气装置应为“短进长出”;④长颈漏斗应换为分液漏斗。……………………………………………………………………………………(每空2分,共8分)
20.………………………………………………………((3)和(5)每空2分,其余每空1分,共10分)
(1)将装置中的N2排净;a,b
|
(3)CxHyOzNp+![]() O2
O2![]() xCO2+
xCO2+![]() H2O+
H2O+![]() N2
N2
(4)吸收未反应的O2,保证最终收集到的气体是反应生成的N2
(5)A、B、D
四、(本题包括2小题,共19分)
|
(2)CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O………………………………………(2分)
CH3COOH+Cu2O↓+2H2O………………………………………(2分)
(3)CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O………………………………………(2分)
CH3COOCH2CH3+H2O………………………………………(2分)
(4)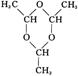 ………………………………………………………………………………………(2分)
………………………………………………………………………………………(2分)
22.…………………………………………………………………………………………(每空2分,共12分)
(1)1.5 0.5
(2)> (3)x=4 (4)=,属于等温等压下的等效平衡(其它合理说法均可)。
五、(本题包括2小题,共19分)
23.…………………………………………………………………………………………(每空2分,共8分)
(1)K=5.00×10-3 (2)c(H2)始=17.50 mol/L
(3)v(N2)=1.25 mol/(L·min) (4)α(N2)=33.3%
24.………………………………………………((1)、(3)和(4)每空1分,其余每空2分,共11分)
(1)90;(2)0.30,5.4;(3)C3H6O3; (4) CH3CH(OH)COOH
(5)![]()
(6) C3H6O3(l)+3O2(g) 3CO2(g)+3H2O(l) △H=-321.2 kJ·mol-1