高二化学第一学期期中考试试卷
高二化学(选修)
考试时间:100分钟 卷面分数:120分
第 Ι 卷(选择题 共60分)
一、选择题(每题只有1个正确答案,每小题3分,共30分)
1.读好课本是学好化学的关键,下列说法与课本不同的是 ( )
A、材料是人类社会进步和发展程度的标志之一
B、最早提出科学的原子概念的是英国科学家道尔顿
C、合金就是一种金属与另一种或几种金属的融合体
D、金属键和离子键都不具有饱和性与方向性
2.空间构型为正四面体,且键角为60°的物质为 ( )
A.金刚石 B.SiO2 C. 白磷 D.石墨
3.下列式子中,真实表示物质分子组成的是 ( )
A、H2SO4 B、NH4Cl C、SiO2 D、C
4、直接由原子构成的一组物质是 ( )
A、碘、二氧化硅、金刚石 B、硅晶体、金刚石、二氧化硅晶体
C、氧化钙、金刚石、二氧化硅晶体 D、碘、石墨、黄铁矿
5.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
6.用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是 ( )
A.苯 B.二硫化碳
C.氯水 D.四氯化碳
7.有关晶体的下列说法中正确的是 ( )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.石墨晶体中,微粒之间只有共价键作用,键角为60°
8.下列分子晶体: ①HCl、②HBr、③HI、④CO、⑤N2、⑥H2沸点由高到低的顺序排列正确的是 ( )
A.①②③④⑤⑥ B.③②①⑤④⑥ C.③②①④⑤⑥ D.⑥⑤④③②①
9.晶体结构属于面心结构的是 ( )
A.Na B Mg C Zn D Cu
10.将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力正确的顺序是 ( )
A、①②②③ B、②①②③ C、②③②① D、①①②③
二、选择题(每题有1-2个正确答案,每小题3分,共30分)
11.下列电子层不包括d轨道的是 ( )
A、N 层 B、M层 C、L层 D、K层
12.下列化学用语错误的是 ( )
A、3d94s2 B、4d105s0
| ↑↓ |
| ↑↑ | ↑ | ↑ |
C、 F- 1S22S22P6 D、 基态碳原子轨道式2S22P4
13.下列各组物质中,化学键类型相同、晶体类型也相同的是 ( )
A、CaCl2和Na2O B、碘、氖 C、CO2和H2O D、CCl4和KCl
14.下列比较错误的有 ( )
A、元素的第一电离能由高到低 Na Mg Al
B、元素的电负性有大到小 F S P
C、键能由大到小 HF HCl HBr HI
D、微粒半径由小到大 F Cl Cl- K+
15.在乙烯分子中有5个σ键、一个π键,它们分别是 ( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
16.1919年,Langmuir提出等电子体的概念:原子数相同、电子总数相同的分子,互称为等电子体;此后,等电子原理又有所发展,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构相似的是 ( )
A.SO2与O3 B.CO2与N2O C.CS2与NO2 D.PCl3与BF3
17.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(KJ·mol-1)Si—O:460、Si—Si:175、O=O:498,则反应:Si + O2 = SiO2的反应热△H为 ( )
 A.-992 KJ·mol-1
B.-247 KJ·mol-1
A.-992 KJ·mol-1
B.-247 KJ·mol-1
C.-236 KJ·mol-1 D.+236 KJ·mol-1
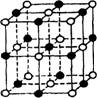
18.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为 ( )
A.TiC B.Ti4C7 C.Til3C14 D.Til4C13
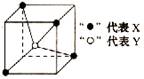 19.常见的离子晶体类型有五种,右图是其中的一种空间构型。则该晶体的化学式可能为
( )
19.常见的离子晶体类型有五种,右图是其中的一种空间构型。则该晶体的化学式可能为
( )
A.YX4 B.YX2 C.YX D.XY2
20.最近科学家成功地合成了一种新型的化合物,该化合物晶体中,每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是 ( )
A.该物质的化学式为CO4
B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C—O化学键之比为1:1
D.晶体的空间最小环共由12个原子所构成
第 Ⅱ 卷(非选择题 共60分)
三、(本题包括6小题,共47分)
21.(6分)化工行业已合成有一种硬度比金刚石还大的晶体——氮化碳,若已知氮在该化合物中显—3价,试推断:
(1) 其化学式可能是_ __________________。
(2)其晶体类型是____________________。
(3) 你认为其硬度比金刚石还大的主要原因是___
22.(8分)有四种同族的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
| 1 | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| 2 | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| 3 | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 4 | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答下列问题:
(1) a为 色液体;b的分子式为: 。
(2) 写出2系列中物质主要化学性质的递变规律(任写1种) ____;能够说明该递变规律的化学事实是: _(任举1例,用离子方程式表示)。
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是______ _____________。
(4)上表中, 和 两种物质的沸点较同系列其它物质反常,反常的主要原因是___ _________
23.(7分)溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是 ,它是由 键形成的 分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 。
24.(1)、(4分) 试述第二周期元素的第一电离能的变化趋势,并从原子结构角度解释有关元素的特殊性。答:
(2)、(4分)果糖分子的结构简式为CH2OH(CHOH)3COCH2OH,试写出其结构式 。并用*标记出其中的手性碳原子;在果糖分子中C原子以何种杂化轨道成键?成何种键?
答:
25.(8分)用“>”或“<”或“=”完成下列填空。
(1)键的极性:H—C H—N。 (2)键角:C2H4 CH4
(3)分子中σ键数目:C2H4 CH4 (4)分子中π键数目:C2H4 C2H2
(5)分子的稳定性:H2O H2S (6)键长: H—C H—N
(7)熔点:正戊烷 新戊烷 (8)还原性:I- Br-
26.(10分)
(1)、在N2、NH3、NH4+、H2O、H3O+、ICl、SO42-中,含有配位键的微粒有 ;
(2)、利用价层电子对数判断分子的空间构型的方法判断如下:CO32-、SO32-、NO2和ClO4-的空间构型分别为 、 、 、和 。
(3) 原子序数为14、15、16 、19、20、21、29、30、的元素中,金属元素有
d区元素有 ,p区元素有 (填原子序数,上同),主族素有 (填元素名称) 。
四、计算题(共13分)
27.(7分)某核素X 的氯化物XCl2 1.11g配成溶液后,需用1mol/L的硝酸银溶液20ml才能把氯离子完全沉淀下来,试计算:
(1)X的质量数
(2)若X核内中子数为20,求37克XCl2 中含质子的物质的量。
28.(6分)若氯化钠晶体中的阴阳离子都是互相接触的。则(1)阳离子与阴离子的半径比为
(2)氯化钠晶体中两个距离最近的钠离子的核间距约为 。(已知氯化钠的式量为58.5,密度为2.2g/cm-3,阿伏加德罗常数为6.02× 1023 mol-)
答案纸
 高二化学(选修)
高二化学(选修)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
| 阅卷人 |
|
|
|
|
请将一、二题的答案填入下表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、(本题包括6小题,共47分)
21.(6分)
(1) 其化学式可能是_ __________________。
(2) 其晶体类型是____________________。
(3)主要原因是___
22.(8分)
(1) a为 色液体;b的分子式为: 。
(2) ___; _
(3)该关系是_____ _ _____________。
(4) 和 , 原因是__ _ _________
23.(7分)(1) , 。
(2) 。
24. (1)、(4分)答:
(2)、(4分)
答:
25.(8分)用“>”或“<”或“=”完成下列填空。
(1) (2) (3) (4)
(5) (6) (7) (8)
26.(10分)
(1)(2分) ;
(2)(4分) 、 、 、和 。
( 3 ) (4分) 、 、 、 。
四、计算题(共13分)
27、(7分)
28、(6分)(1)阳离子与阴离子的半径比为
(2)氯化钠晶体中两个距离最近的钠离子的核间距约为 。(已知氯化钠的式量为58.5,密度为2.2g/cm-3,阿伏加德罗常数为6.02× 1023 mol-)
答案
高二化学(选修)
考试时间:100分钟 卷面分数:120分
第 Ι 卷(选择题 共60分)
一、选择题(每题只有1个正确答案,每小题3分,共30分)
1、读好课本是学好化学的关键,下列说法与课本不同的是( C )
A、材料是人类社会进步和发展程度的标志之一
B、最早提出科学的原子概念的是英国科学家道尔顿
C、合金就是一种金属与另一种或几种金属的融合体
D、金属键和离子键都不具有饱和性与方向性
2、空间构型为正四面体,且键角为60°的物质为 ( C )
A.金刚石 B.SiO2 C. 白磷 D.石墨
3、下列式子中,真实表示物质分子组成的是( A )
A、H2SO4 B、NH4Cl C、SiO2 D、C
4、直接由原子构成的一组物质是 ( B )
A、碘、二氧化硅、金刚石 B、硅晶体、金刚石、二氧化硅晶体
C、氧化钙、金刚石、二氧化硅晶体 D、碘、石墨、黄铁矿
5.下列事实与氢键有关的是 ( B )
A.水加热到很高的温度都难以分解
B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
6、用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是 (C )
A.苯 B.二硫化碳
C.氯水 D.四氯化碳
7、有关晶体的下列说法中正确的是 ( B )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.石墨晶体中,微粒之间只有共价键作用,键角为60°
8、下列分子晶体: ①HCl、②HBr、③HI、④CO、⑤N2、⑥H2沸点由高到低的顺序排列正确的是( C )
A.①②③④⑤⑥ B.③②①⑤④⑥ C.③②①④⑤⑥ D.⑥⑤④③②①
9、晶体结构属于面心结构的是 ( D )
A.Na B Mg C Zn D Cu
10、将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力正确的顺序是 ( B )
A、①②②③ B、②①②③ C、②③②① D、①①②③
二、选择题(每题有1-2个正确答案,每小题3分,共30分)
11、下列电子层不包括d轨道的是 (CD)
A、N 层 B、M层 C、L层 D、K层
12、下列化学用语错误的是(AD)
A、3d94s2 B、4d105s0
| ↑↓ |
| ↑↑ | ↑ | ↑ |
C、 F- 1S22S22P6 D、 基态碳原子轨道式2S22P4
13、下列各组物质中,化学键类型相同、晶体类型也相同的是 ( AC )
A、CaCl2和Na2O B、碘、氖 C、CO2和H2O D、CCl4和KCl
14、下列比较错误的有(AD)
A、元素的第一电离能由高到低 Na Mg Al
B、元素的电负性有大到小 F S P
C、键能由大到小 HF HCl HBr HI
D、微粒半径由小到大 F Cl Cl- K+
15、在乙烯分子中有5个σ键、一个π键,它们分别是 ( A )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
16、1919年,Langmuir提出等电子体的概念:原子数相同、电子总数相同的分子,互称为等电子体;此后,等电子原理又有所发展,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构相似的是( AB)
A.SO2与O3 B.CO2与N2O C.CS2与NO2 D.PCl3与BF3
17.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(KJ·mol-1)Si—O:460、Si—Si:175、O=O:498,则反应:Si + O2 = SiO2的反应热△H为 ( A )
A.-992 KJ·mol-1 B.-247 KJ·mol-1
C.-236 KJ·mol-1 D.+236 KJ·mol-1
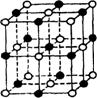 18.最近发现上种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为 (D )
18.最近发现上种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为 (D )
A.TiC B.Ti4C7 C.Til3C14 D.Til4C13
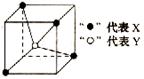 19.常见的离子晶体类型有五种,右图是其中的一种空间构型。则该晶体的化学式可能为(D )
19.常见的离子晶体类型有五种,右图是其中的一种空间构型。则该晶体的化学式可能为(D )
A.YX4 B.YX2 C.YX D.XY2
20.最近科学家成功地合成了一种新型的化合物,该化合物晶体中,每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是(AC )
A.该物质的化学式为CO4
B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C—O化学键之比为1:1
D.晶体的空间最小环共由12个原子所构成
(请将选择题的答案填入下表)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 答案 | |||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 |
第 Ⅱ 卷(非选择题 共60分)
班级 姓名 学号 得分
三、(本题包括6小题,共60分)
21.(6分)化工行业已合成有一种硬度比金刚石还大的晶体——氮化碳,若已知氮在该化合物中显—3价,试推断:
⑴ 其化学式可能是_ C3N4 __________________。
⑵ 其晶体类型是_______原子晶体_______________。
⑶ 你认为其硬度比金刚石还大的主要原因是____ N原子半径比C原子半径小,C—N键键长比C—C键键长小, C—N键键能比C—C键键能大,所以C3N4的硬度比金刚石还大。
22.(8分)有四种同族的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
| 1 | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| 2 | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| 3 | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 4 | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答下列问题:
⑴ a为 沈红棕色 色液体;b的分子式为: H2Se 。
⑵ 写出2系列中物质主要化学性质的递变规律(任写1种)氧化性逐渐减弱____;能够说明该递变规律的化学事实是: Cl2+2Br—=2Cl—+Br2 _(任举1例,用离子方程式表示)。
⑶ 除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的
关系,该关系是_______随着相对分子质量增大,沸点逐渐升高_______________。
⑷ 上表中, HF 和 H2O 两种物质的沸点较同系列其它物质反常,反常的
主要原因是____分子之间易形成氢键_________
![]() 23.(7分)溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
23.(7分)溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:![]() (1)溴化碘的电子式是
,它是由 极性 键形成的 极性 分子。
(1)溴化碘的电子式是
,它是由 极性 键形成的 极性 分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 。
24.(1)、(4分) 试述第二周期元素的第一电离能的变化趋势,并从原子结构角度解释有关元素的特殊性。答:随原子序数的递增元素的第一电离能呈增大的趋势,但是
(2)、(4分)果糖分子的结构简式为CH2OH(CHOH)3COCH2OH,试写出其结构式 。并用*标记出其中的手性碳原子;在果糖分子中C原子以何种杂化轨道成键?成何种键?
H H H H H
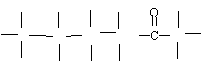
![]() H C* C* C*
C*
C H
H C* C* C*
C*
C H
![]() OH OH OH OH OH
OH OH OH OH OH
其中 中的碳原子是以sp2杂化形成3个σ键和一个π键,而其余的5个碳原子都是以sp3杂化形成4个σ键。
25.(8分)用“>”或“<”完成下列填空。
⑴键的极性:H—C < H—N。 ⑵键角:C2H4 > CH4
⑶分子中σ键数目:C2H4 > CH4 ⑷分子中π键数目:C2H4 < C2H2
(5)分子的稳定性:H2O > H2S (6)键长: H—C > H—N
(7) 熔点:正戊烷 > 新戊烷 (8)还原性:I- > Br-
26.(10分)
(1)、在N2、NH3、NH4+、H2O、H3O+、ICl、SO42-中,含有配位键的微粒有 NH4+ 、H3O+、 SO42- ;
(2)、利用价层电子对数判断分子的空间构型的方法判断如下:CO32-、SO32-、NO2和ClO4-的空间构型分别为 平面三角形 、 三角锥形 、 V形 、和 正四面体 、
(3) 原子序数为14、15、16 、19、20、21、29、30、的元素中,金属元素有 19、20、21、29、30、 d区元素有 21 ,p区元素有 14、15、16 ,主族素有 14、15、16、 19、20 ,
27、(7分)某核素X 的氯化物XCl2 1.11g配成溶液后,需用1mol/L的硝酸银溶液20ml才能把氯离子完全沉淀下来,试计算;(1)X的质量数(2)若X核内中子数为20,求37克XCl2 中含质子的物质的量。40 、18 mol
28(6分)若氯化钠晶体中都是互相接触的。则(1)阳离子与阴离子的半径比为 0.414
(2)氯化钠晶体中两个距离最近的钠离子的核间距约为 3.96*10-8 cm 。(已知氯化钠的式量为58.5,密度为2.2g/cm-3,阿伏加德罗常数为6.02* 1023 mol-)