高二化学第一学期期中考试试卷
(专业班)
说明:
1.本试卷分Ⅰ、Ⅱ两卷。Ⅰ卷为选择题,答题时把正确答案填涂到答题卡上。Ⅱ卷为主观题,答题时把正确答案写到答题纸上。交卷时只交答题卡和答题纸。试卷不交。
2.考试时间:100 分钟。满分:120 分
可能用到的相对原子质量:
第I卷(选择题,满分60分共15小题)
一、选择题(共有9小题。只有一个正确答案,每个小题4分,满分36分)
1.下列说法正确的是
A.吸热反应一定是非自发进行
B.凡是熵增加的过程一定是自发过程
C.改变体系温度,则可逆平衡一定发生移动
D.强电解质溶液的导电性一定比弱电解质强
2.相同温度下,物质的量浓度相同的下列溶液,c(NH4+)大小正确的是
①NH4Cl ②NH4HCO3 ③ NH4HSO4 ④(NH4)2SO4
A. ①②③④ B. ②①④③ C. ④③①② D. ④②③①
3.强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol
已知:①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l) △H=-a kJ/mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) △H=-b kJ/mol
③HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l) △H=-c kJ/mol
则a、b、c三者的大小关系为
A. a>b>c B.b>c>a C.a=b=c D.无法比较
4.氯化铝溶液加热蒸干灼烧得到的固体主要成分是
A.AlCl3 B.Al(OH)3 C.Al2O3 D.Al
5.氢氧化镁悬浊液存在下列平衡:Mg(OH)2(s) ![]() Mg2+(aq)+2OH-(aq),下列有关说法不正确的是
Mg2+(aq)+2OH-(aq),下列有关说法不正确的是
A.加少量水,更多的氢氧化镁溶解
B.加少量NaOH(s), 氢氧化镁的溶解量减少
C.加少量氯化氢,溶液的pH变大
D.加少量MgCl2(s),溶液的pH变小
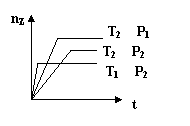 6. 反应2X(g)+Y(g)
6. 反应2X(g)+Y(g)![]() 2Z(g) △H<0,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
2Z(g) △H<0,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
7. 下列的无色溶液中由水电离产生的c(H+)=1×10-13mol/L,则溶液中一定大量共存的离子组别是
A.Na+、Fe3+、Cl- 、SO42- B. Na+、Mg2+、NO3- 、SO42-
C.Na+、K+、 Cl- 、SO42- D. HCO3-、Al3+、Cl- 、NO3-
8.0.1mol/LHCl溶液50mL与0.05mol/LNH3·H2O溶液100mL混合。下列各微粒的式子不正确的是
A.c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)> c(H+)> c(OH-)
C.c(NH4+)+ c(NH3·H2O)= c(Cl-)
D.c(Cl-)+c(OH-)=c(H+)+c(NH4+)
9.常温下pH=3的盐酸与pH=9的NaOH溶液等体积混合(假设体积等于混合前两溶液体积和),混合溶液中c(H+)的计算式是
A.
![]() B.
B.
![]()
C.
![]() D.
以上计算式都不对
D.
以上计算式都不对
二、选择题(共有6小题。每小题有1~2个正确答案,每个小题4分,满分24分。若只有一个正确答案答对给4分;若两个正确答案,仅答一个且是其中一正确答案,给2分)
10.NA表示阿伏加德罗常数,下列叙述中正确的是
A.1L0.1mol/L的FeCl3溶液中的阳离子总数大于0.1NA
B.1mol钠与足量水反应,反应中转移的电子总数大于NA
C.1L 1mol/L的醋酸溶液中分子总数小于NA
D.1LpH=1的盐酸溶液中的氢离子总数大于0.1NA
11.下列事实能够说明亚硝酸为弱电解质的是:
A.NaNO2的水溶液的 pH > 7 B.亚硝酸不与硫酸钠溶液反应
C.0.1mol/L 的亚硝酸水溶液的 pH = 2.1 D.用亚硝酸做导电实验时, 灯泡很暗
12已知某反应:C(s、石墨)= C(s、金刚石) △H=+1.9kJ/mol,则表明
A. 通常石墨比金刚石稳定
B. 通常金刚石比石墨稳定
C. 1mol金刚石总键能比1mol石墨总键能大
D. 1mol石墨总键能比1mol金刚石总键能大
13.在一密闭容器中,反应 aA(气)![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
14.下列离子方程式正确的是
A. 氯气通入水中 Cl2+H2O=2H++Cl-+ClO-
B. 碳酸钠溶液成呈碱性
CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.过氧化钠与水反应 2O2-+2H2O=4OH-+O2↑
D.氯化银投到硫化钠溶液中 2AgCl+S2-=Ag2S+2Cl-
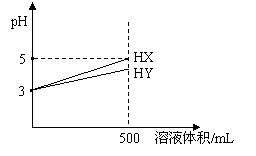
15.pH=3的一元酸HX与HY溶液各5mL,加水稀释至500mL(如图示),下列说法正确的是
A.稀释前后酸性都增强
B.HX是强酸,HY是弱酸
C.稀释至500mL时HX溶液的酸性强于HY的酸性
D.同浓度NaOH溶液中和以上两种溶液,消耗NaOH的体积HX小于HY
第II卷(非选择题,满分60分)
三、实验题(含2小题。5+10)
 16.(1)下列试验操作或说法正确或实验结果无误差的是
16.(1)下列试验操作或说法正确或实验结果无误差的是
A.中和热测定实验中以环形铁丝搅拌棒可代替环形玻璃搅拌棒
B.在中和热的测定实验中,准确量取0.55mol/L的NaOH溶液50mL和0.50mol/L的HCl溶液50mL在保温性好的量热器中进行
C.用标准HCl溶液滴定未知浓度的NaOH溶液,碱式滴定管可以不润洗就量取20.00mLNaOH溶液注入锥形瓶
D.用标准HCl溶液滴定未知浓度的NaOH溶液,用蒸馏水冲洗锥形瓶内壁
E.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后再用蒸馏水稀释并放入少量铁粉
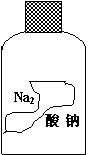
(2)某实验室中的盖有橡皮塞、标签严重腐蚀的试剂瓶,如上图所示,经初步检测其中溶液的pH>7。请猜测溶液的成分可能是 、 (写出两种化学式)。
17.某研究性学习小组为模拟合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g)
△H=-92.4kJ/mol
2NH3(g)
△H=-92.4kJ/mol
设计实验探究方案如下:
一、实验记录:
|

|

二、请你参与以下探究:
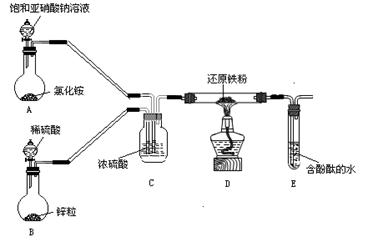
(1) 交流卡片I中,B装置生成H2的离子方程式是: ;
A装置反应开始后移去热毛巾,反应继续迅速进行说明 ;
(2) C装置除了通过气泡数目控制N2、H2的流量外,还有的作用是 (选填a、b或ab);
a.干燥除去水蒸气 b.使气体充分混合
(3) 讨论:
①实验中B装置的反应速率明显较低,除了升温外还可以 来提高反应速率;
②写出E装置的溶液呈红色的有关化学方程式 ;
③如果D中通入N2和H2各1mol、3mol,为什么反应放出的热量总比92.4kJ少。
。
四、填充题(本题含2小题。8+7)
18.现有如下六物质:①醋酸、 ②铁、③氢氧化钡、④氯化铝(共价化合物)、⑤乙醇、 ⑥碳酸钾。请用物质的序号填写下列空格及按要求书写方程式:
(1)属于强电解质的有: 、属于弱电解质的有: 、
属于非电解质的有: 、液态时能导电的有: ;
(2)④的水溶液呈酸性,有关方程式是 ;
④⑥溶液混合反应的离子方程式 。
19.某化学兴趣小组研究草酸(乙二酸,HOOC-COOH)的性质,他们查找了相关数据。
| 化学式 | 电离常数/25℃ |
| CH3COOH | K=1.76×10-5 |
| H2C2O4 | K1=5.90×10-2 K2=6.40×10-5 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
(1)0.1mol/L的CH3COOH、H2C2O4 、H2SO3 溶液pH最小的是 ,最大的是 ;
(2)KHSO3溶液的呈酸性,表明HSO3-的电离 水解(选填“强于、弱于或等于”);
(3)0.1mol/L的H2C2O4 溶液与0.1mol/LNaOH溶液等体积混合,溶液的pH=a (溶液的体积等于混合前体积和) 。
①则a 7(选填“>” “<”“=”或“不确定”)
②c(HC2O4—)+2c(C2O42—)= (用含a的代数式表示)
五、填充题(本题含2小题。6+10)
20.将2 mol A和2 mol B充入某密闭容器中发生反应:2A(g) + B(g) ![]() xC(g) △H>0,达到化学平衡后,C的体积分数为a。
xC(g) △H>0,达到化学平衡后,C的体积分数为a。
(1)此反应的化学平衡常数是K= (用含x、各平衡浓度如c(A)、c(B)、c(C)等的代数式表示),若温度升高则平衡时的K (选填“增大、减小或不变”);
(2)假设该反应的条件分别和下列各选项的条件相同,选填“甲、乙、丙、”:
①若在恒温恒容下,当x = 1时,按1 mol B、l mol C作为起始物质,达到平衡后,C的体积分数为 ;
②若在恒温恒容下,当x = 2时,将2 mol C作起始物质,达到平衡后,C的体积分数为 ;
③若在恒温恒容下,当x = 3时,2 mol B、6 mol C作起始物质,达到平衡后,C的体积分数为 ;
④若在恒温恒压下,按3 mol A、3 mol B作起始物质,达到平衡后,C的体积分数为 。
甲.大于a 乙.小于a 丙.等于a
21.在一体积为2L的密闭容器中,通入一定量的N2和H2,在500℃时发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol,其有关图表如下。
2NH3(g) △H=-92.4kJ/mol,其有关图表如下。
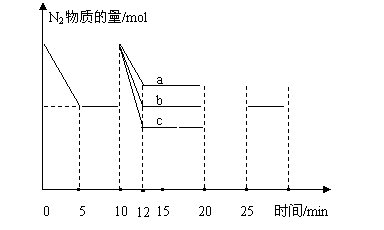
| N2/mol | H2/mol | NH3/mol | |
| 起始 | 1 | 3 | 0 |
| 平衡 | 0.6 |
(1)0~5min内H2的平均速率是 ,平衡时NH3的物质的量分数是 ;
(2)10min时增加0.4molN2(其它量、条件不变),则10~20min内的图像变化是 (选填a、b、c)
20min时改变下列条件,则25min到达平衡时的量如图。该条件可能是
a.降温 b. 充入H2 c.充入2molHe d. 充入NH3
(3)若起始充入N2、H2、NH3的物质的量分别是x mol、y mol、0 mol平衡时NH3的物质的量分数恰好同(1),则 < ![]() <
<
六、计算题(本题含2小题。4+10)
22.NH3(g)燃烧生成NO2(g)和H2O(l),已知下列反应:
① H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
②
![]() N2(g)+O2(g)=NO2(g)
△H=+33.9kJ/mol
N2(g)+O2(g)=NO2(g)
△H=+33.9kJ/mol
③ ![]() N2(g)+
N2(g)+ ![]() H2(g)=NH3(g) △H=-46.0kJ/mol
H2(g)=NH3(g) △H=-46.0kJ/mol
求:(1)NH3(g)燃烧的化学方程式 ;
(2)NH3(g)的燃烧热Q= kJ/mol。
23.常温下100mL氢氧化钙和氢氧化钠混合溶液的pH=14,向该溶液中持续通入CO2气体,当通入到0.56L(已折算为标准状况下的体积,下同)CO2气体时,溶液中的沉淀量最大。
(1)原溶液中氢氧化钙和氢氧化钠物质的量浓度分别是 、 ;
(2)若通入的CO2气体的体积为V L,则填写下表有关数据
(不考虑溶解平衡、水解、电离平衡,最终溶液的体积仍为100mL)
| V/L | n(CO32-) | n(HCO3-) |
| 1.12 | ||
| 1.68 | ||
| 2.24 |
![]()
高二化学(专业班)期中试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | B | C | C | C | C | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | B | A | AC | AD | C | D | BD |
16.(1)BDE(2)Na2CO3、Na2SO3
17.(1)Zn+2H+=Zn2++H2↑ 该反应为放热反应
(2) ①②
(3) ①适当提高硫酸浓度等
②NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
③合成氨是可逆反应,不可能生成2mol氨气,放出热量一定小于92.4kJ
18.(1)③④⑥ ,①,⑤ ,②③⑥ ;
(2)Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
2Al3++3CO32-+3H2O=3CO2↑+2Al(OH)3↓
19.(1)H2C2O4 CH3COOH (2)强于 (3) ①< ②0.05+10-a-10-14+a
20.(1)![]() ,增大
,增大
(2)①丙②乙③丙④丙
21.(1)0.12mol/L·min,25%
(2)a,ab (3)![]() >
>![]() >
>![]()
22.(1)方程式是:4NH3+7O2=4NO2+6H2O
(2) 燃烧热Q=348.8kJ/mol
23.
| V/L | n(CO32-) | n(HCO3-) |
| 1.12 | 0.025 | 0 |
| 1.68 | 0 | 0.050 |
| 2.24 | 0 | 0.10 |