高二化学第一学期期中试卷
化 学
命题人:俞骏 校对人:徐庆辉
考生须知:
1、本试卷分试题卷和答题卷,满分100分,考试时间 90分钟。
2、答题前,在答题卷密封区内及答题卡上填涂班级、姓名和学号。
3、选择题答案必须用2B铅笔涂在答题卡上,其余答案写在答卷上
写在试卷上无效。
4、考试结束,只需上交答题卷。
5、可能用到的相对原子质量:H-1,C-12,N-14,O-16,Al-27,Fe-56,Cu-64,
Zn-65。
第I卷(选择题,共40分)
一、选择题(本题有20小题,每题2分,共40分,选出各题中一个符合题意的选项,不选、多选、错选均不给分)
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
2.第二次世界大战期间,某国侦察小分队到德国法西斯一座十分隐蔽且又戒备森严的军火厂,上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药剂的老鼠完成了任务。据你推测这种药剂是
A.黑火药和酒精 B.白磷和二硫化碳溶液 C.高锰酸钾和硫酸 D.硝酸铵和水
3.下列关系不正确的是
A.非金属性:N>P>As>Sb>Bi B.酸性:HNO3>H3PO4>H3AsO4>H3SbO4>H3BiO4
C.稳定性:NH3<PH3<AsH3<SbH3<BiH3 D.稳定性:HCl>H2S>PH3>SiH4
4.将下列固体于隔绝空气的密闭容器中加热,在加热过程中发生了化学反应,但冷却后又聚集为原来物质的是
A.NH4Cl B.NH4I C.碘片 D.红磷
5.往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
A.颜色变浅 B.逐渐加深 C.没有改变 D.变棕黄色
6.一定条件下将等体积的NO和O2的混合气体置于试管中,并将试管倒立于水槽中充分反应后,剩余气体的体积约为原总体积的
A.1/4 B.3/4 C.1/8 D.3/8
7.
在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI![]() H2+I2
(气)
。下列叙述中一定属于平衡状态的是
H2+I2
(气)
。下列叙述中一定属于平衡状态的是
A. HI、H2、I2的浓度相等 B. 混合气体的颜色不变化时
C. 混合气体的总压不变时 D. v(HI):v(H2):v(I2)=2:1:1时
8.某单质能跟浓HNO3 反应,若参与反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是
(1)+1 (2)+2 (3)+3 (4)+4
A.(1)(2)(3)(4) B.(2) C.(3)(4) D.(2)(4)
9.对于反应:4NH3(g)
+ 5O2(g) ![]() 4NO(g)
+ 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
4NO(g)
+ 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
A. V(NH3) = 0.2mol·L-1·s-1 B.V(O2) = 0.24 mol·L-1·s-1
C. V(H2O)= 0.25 mol·L-1·s-1 D.V(NO) = 0.15 mol·L-1·s-1
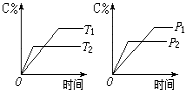 10.可逆反应mA(s)+nB(g)
10.可逆反应mA(s)+nB(g)
![]() pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后,增大A的量,有利于平衡向正反应方向移动
 D.化学方程式中一定n>p+q
D.化学方程式中一定n>p+q
11.一定条件下,将X和Y两种物质按不同比例
放入密闭容器中,反应达平衡后,测得X、Y转
化率与起始时两种物质的量之比nx/ny 的关系如
图,则X和Y反应的方程式可表示为
A.X+3Y![]() 2Z B.3X+Y
2Z B.3X+Y![]() 2Z
2Z
C.3X+2Y![]() Z
D.2X+3Y
Z
D.2X+3Y![]() 2Z
2Z
12.密闭容器中,反应xA(g) +
yB(g)![]() zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是
zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是
 A. x+y <
z B. 平衡向正反应方向移动
A. x+y <
z B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数上升
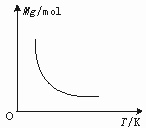
13.可逆反应2X+Y![]() 2Z(g) 正反应放热 达到平衡时,气体的平均摩尔质量(M)随温度变化如图2所示,则下列说法中正确的是
2Z(g) 正反应放热 达到平衡时,气体的平均摩尔质量(M)随温度变化如图2所示,则下列说法中正确的是
A.X和Y可能都是固体 B.X和Y一定都是气体
C.若Y为固体,则X一定是气体 D.X和Y一定都是固体
14.下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
15.pH=2和pH=4的两强酸溶液等体积混和后,所得溶液的PH值大约为
A.2.3 B.3 C.4.3 D.8
16.下列溶液肯定是酸性的是
A.含H+的溶液 B.加酚酞显无色的溶液 C.pH<7的溶液 D.C(OH-)< C(H+)的溶液
17.有人建议用AG表示溶液的酸度,AG=lg{C(H+)/C(OH-)},下列表述正确的是
A.在25℃时,若溶液呈碱性,则PH>7,AG>0
B.在25℃时,若溶液呈酸性,则PH<7,AG<0
C.在25℃时,若溶液呈中性,则PH=7,AG=1
D.在25℃时,溶液的PH与AG的换算公式为AG=2(7-PH)
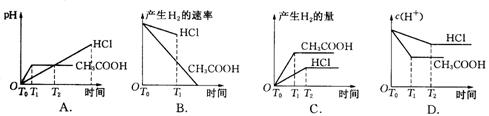 18.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是
18.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是
19.反应Fe + HNO3 → Fe(NO3)3 + H2O + ,若铁跟起氧化作用的硝酸的物质的量之比
为4:3,则方框内的物质是
A.NO2 B.NO C.N2O D.N2
20.在铁和铜的混和物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1 g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是( )
A.m1一定大于m2 B.m1可能大于m2 C.m1可能等于m2 D.m1一定等于m2
第II卷(非选择题,共60分)
二、填控题(本大题共5小题,共30分)
21.(1)在稀CH3COOH溶液中加入适量的CH3COONa固体后,溶液的pH ▲ ;
(2)在稀HNO3溶液中加入NaNO3固体后,溶液的pH ▲ 。
(填“增大”、“减小”,“不变”)
22.在一定条件下,反应A(气)+B(气)![]() C(气) ( 正反应放热) 达到平衡后,根据下列图象判断
C(气) ( 正反应放热) 达到平衡后,根据下列图象判断
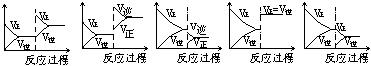
A. B. C. D. E.
(1)升温,达到新的平衡的是 ▲ ;(2)降压,达到新的平衡的是 ▲ ;
(3)减少C的量,移向新平衡的是 ▲ ;(4)增加A的量,移向新平衡的是 ▲ 。
23.在一固定容积的密闭容器中,一定条件下,可逆反应A2+B2![]() 2C,达到化学平衡状态,经测得平衡时:c(A2)=0.5 mol /L,c(B2)=0.1 mol /L,c(C2)=1.6 mol /L,若A2,B2,C的起始浓度分别用amol/L,bmol/L,cmol/L表示,请回答:
2C,达到化学平衡状态,经测得平衡时:c(A2)=0.5 mol /L,c(B2)=0.1 mol /L,c(C2)=1.6 mol /L,若A2,B2,C的起始浓度分别用amol/L,bmol/L,cmol/L表示,请回答:
(1)a,b之间应满足的关系是: ▲ ;(2)a的取值范围是: ▲ 。
24.将VmLNO和NO2的混和气通过水吸收后,得到a mL无色气体A,将此无色气体A与等体积O2体积混合,再通过水充分吸收后,收集到5mL无色气体B,试回答:
(1)A气体是 ▲ ,B气体是 ▲ ;(2)A气体的体积a是 ▲ mL;
(3)V的取值范围是 ▲ ;
25.pH为12的NaOH溶液100mL,要使它的PH=11
(1)如加入蒸馏水,应加 ▲ mL;
(2)如加入PH=10的NaOH溶液,应加入 ▲ mL;
(3)如加入0.010mol/L的盐酸,应加入 ▲ mL。
三、实验题(本大题共3小题,共18分)
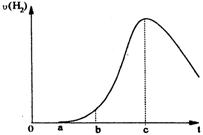 26.把在空气中久置的铝片5.0 g投入盛有
500 ml 0.5 mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
26.把在空气中久置的铝片5.0 g投入盛有
500 ml 0.5 mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因 ▲ ,
有关的化学方程式为 ▲ ;
(2)曲线由a→b段产生氢气的速率较慢的原因 ▲ ;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因 ▲ ;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因 ▲ 。
 27.如图所示,在一盛有500mL液体A的烧杯中有一悬浮的小球(小球不与液体发生反应):
27.如图所示,在一盛有500mL液体A的烧杯中有一悬浮的小球(小球不与液体发生反应):
(1)若液体A是10mol/L的氨水,向烧杯中慢慢加入1mol氯化镁固体,
搅拌后静置,小球将 ▲ (选填“下沉”或“上浮”)反应的离子方程式为 ▲ ;
(2)若液体A是蒸馏水,向其中分若干次加入金属钠共计15g,小球
将 ▲ (选填“下沉”或“上浮”)。反应后,溶液中由水电离
产生的c(OH-)将_ ▲ (填“增大”、“减小”,“不变”)
28.实验室要制取氨气并完成喷泉实验。
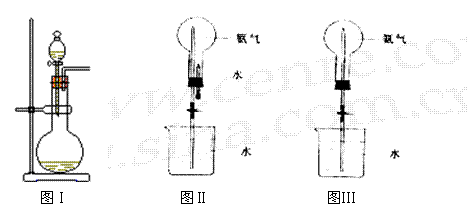 |
(1)实验室选用图Ⅰ装置来制取氨气,
试剂有:①NH4Cl(s) 、②Ca(OH)2(s)、③NH4NO3(s)、④浓氨水、⑤氢氧化钠溶液、⑥CaO(s) 最合适的试剂是_ ▲ (填编号);
(2)如果图Ⅱ的装置有3个,烧瓶中分别盛有:①纯氨气、①含有1/10空气的氨气、③纯二氧化氮,在相同条件下分别进行喷泉实验,理论上得到的溶液物质的量浓度为_ ▲ ;
A.①=②=③ B.①>②>③ C.①>③>② D.②>①>③
(3)如果只提供如图Ⅲ的装置,请说明引发喷泉的方法_ ▲ 。
四、计算题(本大题共2小题,共12分)
29.在容积为3L的密闭容器中盛有N2和H2,在一定条件下发生反应,经过5min后达到化学平衡,此时容器中含有0.9molN2, 1.2molH2, 3molNH3,则H2起始浓度为_ ▲ ,
H2的转化率_ ▲ 用H2表示的反应速率v(H2)=_ ▲ ,平衡时混合气体的平均相对分子质量为_ ▲ 。
30. 25.6mg铜与含有1.4×10-3mol的浓硝酸恰好完全反应,放出的气体用排四氯化碳液体的方法收集,其气体的体积在标准状况下为多少mL?(不考虑生成N2O4)。将收集到的气体倒立于水槽中,向其中通入标准状况下的O2多少才能使气体全部生成硝酸?