高二化学第一学期期中试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷总分120分.答卷时间100分钟.
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27
Cl:35.5 Cu:4 Ag:108
第Ⅰ卷(选择题 共64分)
选择题的答案请填在第II卷的表格中.
一、选择题(本题包括8小题,每小题3分,共24分.每小题只有一个选项符合题意)
1.能源危机是制约现代社会发展的严重问题,开发和利用新能源是中国立足自身解决能源困扰的重要举措之一.背景材料:①.2005国际油价飙升,新型纳米金属燃料面世;②.2006年1月1日,“苏北五市”全面推广使用乙醇汽油;③.到2010年,江苏省将打造成为全国最重要的太阳能产业基地;④.生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯.下列说法正确的是
A.乙醇汽油的推广使用大大降低了国际市场的原油价格
B.生物柴油燃烧不会产生二氧化碳,是一种清洁能源
C.石油是一种清洁安全的可再生能源
D.纳米金属燃料表面积大,易引发,能量释放快
2.下列反应中生成物总能量低于反应物总能量的是
A.氢气还原三氧化钨 B.高锰酸钾分解
C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
![]() 3.对于反应:4NH3(g)
+ 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
3.对于反应:4NH3(g)
+ 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
A.v(NH3)= 0.2mol·L-1·s-1 B.v(O2 )= 0.24 mol·L-1·s-1
C.v(H2O )= 0.25 mol·L-1·s-1 D.v(NO) = 0.15 mol·L-1·s-1
4. 在密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
5.在一个绝热的体积一定的密闭容器中发生可逆反应:
N2(g) + 3H2(g) ![]() 2NH3(g)
; △H<0
2NH3(g)
; △H<0
下列各项中不能说明该反应已经达到平衡状态的是
A.体系的压强不再改变
B.体系的温度不再改变
C.断裂1mol N≡N键的同时,也断裂6molN—H键
D.反应消耗的 、与产生的的速率υ() : υ() : υ() == 1∶3 ∶2
6.已知热化学方程:
2KNO3(s) = 2KNO2(s) +O2(g);△H = +58kJ/mol
C(s) +O2(g) = CO2(g);△H =-94kJ/mol
为提供分解1molKNO3所需的能量,理论上需完全燃烧碳
A.58/94mol B.58/(94×2) mol C.(58×2)/94mol D.(94×2)/58mol
7.同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+![]() O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
8.已知热化学反应方程式:
Zn(s)+![]() O2(g)
O2(g)![]() ZnO(s);ΔH=-351.5 kJ·mol-1
ZnO(s);ΔH=-351.5 kJ·mol-1
Hg(l)+![]() O2(g)
O2(g) ![]() HgO(s);ΔH=-90.84 kJ·mol-1
HgO(s);ΔH=-90.84 kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
![]() ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
A. ΔH=+260.7 kJ·mol-1 B. ΔH=-260.7 kJ·mol-1
C. ΔH=-444.2 kJ·mol-1 D. ΔH=+444.2 kJ·mol-1
二、选择题(本题包括10小题,每小题4分,共40分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
![]()
![]()
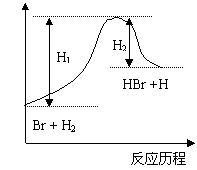 9.参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列叙述中正确的
9.参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列叙述中正确的
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热不改变
C. 正反应为吸热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
10.下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H =—216kJ/mol,E反应物>E生成物
B.CaCO3(s)=CaO(s)+CO2(g); △H =+178.5kJ/mol,E反应物>E生成物
![]() C.HI(g) 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol
HI在密闭容器中分解后可以放出26.5kJ的能量
C.HI(g) 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol
HI在密闭容器中分解后可以放出26.5kJ的能量
D.H+(aq)+OH-(aq)=H2O(l);△H = —57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ
11.下列热化学方程式中的反应热下划线处表示燃烧热的是
A.C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l);ΔH=-akJ·mol-1
6CO2(g)+6H2O(l);ΔH=-akJ·mol-1
B.CH3CH2OH(l)+![]() O2(g)
O2(g)![]() CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
C.CO(g)+ ![]() O2(g)
O2(g)![]()
![]() CO2(g);ΔH=-c kJ·mol-1
CO2(g);ΔH=-c kJ·mol-1
D.NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(g);ΔH=-d
kJ·mol-1
H2O(g);ΔH=-d
kJ·mol-1
12.强酸和强碱稀溶液的中和热可以表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①.HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=a kJ·mol-1
②.HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=c kJ·mol-1
③.HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=b kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.c>b>a C.a=b=c D.a >c> b
![]() 13.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
13.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
14.下列说法正确的是
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数增大,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
15.工业上生产苯乙烯是利用乙苯在560度时的脱氢反应:
C8H10 (g) ![]() C8H8(g)
+ H2(g)
C8H8(g)
+ H2(g)
针对上述反应,有人提出如下观点,其中合理的是:
A.在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率
C.在乙苯反应达到平衡过程中,体系的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件
16.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g);△H<0
2C(g);△H<0
达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 增大体积 | A的转化率 |
| D | 降低温度 | 混合气体的密度 |
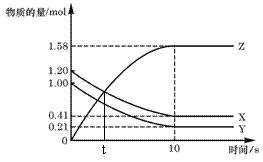 17.一定温度下,在2 L的密闭容器中,X、Y、Z
17.一定温度下,在2 L的密闭容器中,X、Y、Z
三种气体的物质的量随时间变化的曲线如右图,
下列描述正确的是
A.t秒时该反应达到化学平衡状态
B.反应开始到10 s,X的物质的量浓度减
少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g)![]() 2Z(g)
2Z(g)
18.加热装有1
molHI气体的定容密闭容器,在t1 ℃,2HI(g)![]() H2(g)+I2(g);△H<0反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2
molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是
H2(g)+I2(g);△H<0反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2
molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是
A.若t1=t2,则x1=x2 B.若t1=t2,则x1<x2
C.若t1<t2,则x2< x1 D.若t1<t2,则x1=x2
第Ⅱ卷(非选择题 共56分)
请将选择题的答案填在下表中.
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、填空题(本题包括5小题,共42分)
19. (7分)近几十年来,对以氢能源作为未来动力燃料的研究获得了迅速发展.像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等.
(1).为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料
(2).燃烧氢气时耗氧量小,发热量大.已知4克H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为: .
(3).碳燃烧的热化学方程式为: C(g) + O2(g)= CO2 (g) ; △H= —393.5kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是 .
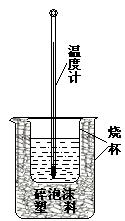 20.(14分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
20.(14分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(1).该图中有两处未画出,它们是 、
.
(2).在操作正确的前提下,提高中和热测定准确性的关键是
____________________ .
(3).做一次完整的中和热测定实验,温度计需使用_______次.
(4).把温度为13℃,浓度为1.0 mol·L-1的酸溶液和1.1mol·L-1的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容
c=4.184J/(g·℃)],轻轻搅动.测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3·H2O | 13 | 19.3 | △H2 |
①.试计算上述两组实验测出的中和热:△H1=________;△H2=________.
②.两组实验结果差异的原因是________________________________.
21. (3分)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量. 已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1.由N2和H2合成1molNH3时可放出46.2kJ的热量. N-H键的键能是______________.
22.(7分)在密闭容器中,通入amolN2和bmolH2,在一定条件下达到平衡,容器中还剩余cmolN2.
(1).生成NH3的物质的量为 .
(2).平衡时H2的转化率为 .
(3).若把容器体积减小一半,则正反应速率 ,逆反应速率 ,N2转化率 .(填“变大”、“变小”、或“不变”)
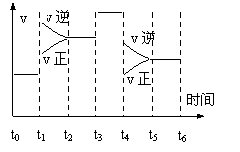 23. (5分)一密闭容器中发生下列反应:
23. (5分)一密闭容器中发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0
下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1). t1、t3、t4时刻,体系中分别是什么条件发生了
变化?
______________________ 、______________________、 ____________________.
(2).下列时间段中,氨的百分含量最高的是_________.
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
24.(6分)在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应到达平衡时有3molSO2发生了反应.试填写下列空格:
(1).平衡时体系中O2的体积分数为__________.
(2).该温度下,反应 2SO2(气)+O2(气)![]() 2SO3(气) 的平衡常数K= .
2SO3(气) 的平衡常数K= .
(3).若平衡时容器内压强为P,则反应前容器内的压强为 (用P表示).
四、计算题(本题包括2小题,共14分)
25.(6分)已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ); △H = -483.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比.
26.(8分)在温度为373K时,把11.5g NO2气体通入体积为500ml的真空密闭容器中,发生反应:2NO2(g)![]() N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
⑴.开始时2s内以c (NO2)的变化表示的反应速率是多少?
⑵.达到平衡时体系内的压强是开始的多少倍?
高二化学(选修)期中试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | D | C | A | B | D | B | D | B | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BC | A | AC | D | C | BD | B | A | CD | AC |
19.(1). C (2分)
(2). H2 (g) + 1/2O2 (g)= H2O (l) ; △H= —285.8kJ/mol (2分)
(3). 4.36 :1 (3分)
20.(1). 环形玻璃棒 烧杯上方的泡沫塑料盖
(2).提高装置的保温效果 (3).3
(4). ①. 根据给出的酸和碱的物质的量,酸为0.050mol,碱为0.055mol,碱是过量的,应以酸计算,算出生成0.050mol水放出的热量,进而算出生成1mol水放出的热量,即可得出两组实验测出的中和热数值.
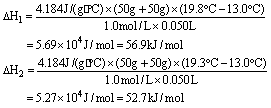
②. NH3·H2O是弱碱,少部分电离,发生电离时要吸热,中和时放热较少. (每空各2分)
21.391.6 kJ·mol-1 (3分)
22.(1).2(a-c)mol (2分) (2).3(a-c)/b (2分)
(3).变大 变大 变大 (每空各1分)
23.(1).升高温度 ;加入催化剂 ; 降低压强 (每空各1分) (2). A (2分)
24. (1).23.07% (2).15 (3).1.23P (每空各2分)
25. 4:1 (6分)
26.(1). 0.1mol/L·s (2).0.8 (各4分)