高二化学第一学期期中试卷
| 题号 | 一、选择题 | 二、填空题 | 三、实验题 | 四、计算题 | 总分 |
| 满分 | 48 | 20 | 22 | 10 | 100 |
| 实得分 |
相对原子质量:Na-23 N-14 O-16 H-1
一、选择题(1-10小题中每题只有一个正确答案,11-16小题有1~2正确答案)
1、氮气是一种很不活泼的气体,其根本原因是 ( )
A.氮元素的非金属性较弱 B.氮原子半径小,核对外层电子吸引力较强
C.氮气为双原子分子 D.使N≡N键断裂需要很高的能量
2.在一学生实验报告中列出的下列数据里合理的是: ( )
A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.1 D.用滴定管取21.70mL溶液
3.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
4.下列各组物质中,互为同素异形体的是 ( )
A.氕和氘 B.O2和O3 C.NO和NO2 D.氯水和液氯
5.实现下列变化,必须加入氧化剂或还原剂的是 ( )
![]()
![]()
![]()
![]() A.NO2 HNO3+NO B.NH4+ NH3 C.NH3 NO D.P2O5 H3PO4
A.NO2 HNO3+NO B.NH4+ NH3 C.NH3 NO D.P2O5 H3PO4
6.在一定温度和压强下,将一支容积为15 mL的试管充满NO2后,倒置于一个盛水的水槽中。当试管内液面上升到一定高度不再变化时,在相同条件下再通入O2。若要使试管内液面仍保持在原高度,则通入O2 的体积为 ( )
A.3.75 mL B.7.5 mL C.8.75 mL D.10.5 mL
7.某无色混合气体依次通过浓H2SO4和Na2O2,若气体体积不断减少,最后颜色变深,则原混合气体的成份可能是 ( )
A.H2、Cl2、H2S B.NH3、NO、CO2 C.NH3、O2、NO D.HCl、NO2、CO2
8.在水电离出C(H+)=1×10-14 mol/L的溶液中一定能大量存在的离子组 ( )
A.K+、Fe2+、Cl-、![]() B.Na+、K+、
B.Na+、K+、![]() 、S2-
、S2-
C.Al3+、![]() 、
、![]() 、Cl- D.Na+、K+、Br-、
、Cl- D.Na+、K+、Br-、![]()
9.某可逆反应2A(g)+3B(g)
![]() xC(g)+4D(g),若按下列两组配比:①
0.8
mol A、1.2 mol B、1.2
mol C、2.4 mol D ② 1.4
mol A、2.1 mol B、0.6
mol C、1.2 mol D 分别在容积不变的同一密闭容器中,一定温度下反应达平衡后,C的质量分数相等。化学方程式中x为 ( )
xC(g)+4D(g),若按下列两组配比:①
0.8
mol A、1.2 mol B、1.2
mol C、2.4 mol D ② 1.4
mol A、2.1 mol B、0.6
mol C、1.2 mol D 分别在容积不变的同一密闭容器中,一定温度下反应达平衡后,C的质量分数相等。化学方程式中x为 ( )
A. 1 B. 2 C. 3 D. 4
10.已知弱电解质在溶液中的电离度是用已电离的弱电解质的分子数占原弱电解质分子总数的百分数来表示的。现室温下,0.1 mol /L的下列溶液中,水的电离度大小排列正确的是
① AlCl3 ② KNO3 ③ NaOH ④ NH3 ( )
A. ①>②>③>④ B. ①>②>④>③ C. ③>④>②>① D. ①=②=③=④
11.将3 mol A和1 mol B混合于一体积可变的密闭容器中,以此时的温度、压强和体积作为起始条件,发生反应:3A(g)+B(g)![]() 2C(g)+D(g),平衡时C的浓度为w
mol·L-1。若反应过程中保持起始温度和压强不变,达到平衡时C的浓度仍为w
mol·L-1。按下列4种方法配比能达到上述目的的是
( )
2C(g)+D(g),平衡时C的浓度为w
mol·L-1。若反应过程中保持起始温度和压强不变,达到平衡时C的浓度仍为w
mol·L-1。按下列4种方法配比能达到上述目的的是
( )
A.2 mol C+1 mol D B.3 mol A+1 mol B+2 mol C
C.6 mol A+2 mol B D.2 mol C+1 mol B+1 mol D
12.实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l,0.1 mol/L某一元碱(BOH)溶液里:C(H+)/C(OH-)=10-12。将这两种溶液等体积混合后,所得溶液里各粒子的物质的量浓度的关系不正确的是 ( )
A.C(B+)>C(A-)>C(OH-)>C(H+) B.C(A—)>C(B+)>C(H+)>C(OH-)
C.C(B+)+C (H+)=C(A-)+C(OH-) D.C(B+)=C(A-)+C(HA)
13.工业上合成氨的反应为:N2(g)+3H2(g) ![]() 2NH3(g);(正反应为放热反应),则下列说法正确的是:
( )
2NH3(g);(正反应为放热反应),则下列说法正确的是:
( )
A.通常采用2×107Pa~5×107Pa的压强,是因为在该压强下铁触媒的活性最大
B.合成氨工业的反应温度控制在500℃,目的是使化学平衡向正反应方向移动
C.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高。
D.为了增加NH3的产率、使平衡向正反应方向移动,工业上要使用催化剂
14.在一定温度下,向aL密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g).反应达到平衡的标志是 ( )
2Z(g).反应达到平衡的标志是 ( )
A.容器内压强不随时间变化 B.容器内X、Y、Z的浓度之比为l :2 :2
C.容器内各物质的浓度不随时间变化 D.单位时间消耗O.1 molX同时生成O.2 molZ
15.4体积pH=9的Ca(OH)2溶液与1体积pH=13的NaOH溶液混合后,溶液中水电离的氢离子浓度为 ( )
A. 5×10-13 mol / L B. 5×10-9 mol / L
C. ![]() ×(1×10-13+4×10-9) mol / L D.
×(1×10-13+4×10-9) mol / L D. ![]() ×(1×10-13+8×10-9) mol / L
×(1×10-13+8×10-9) mol / L
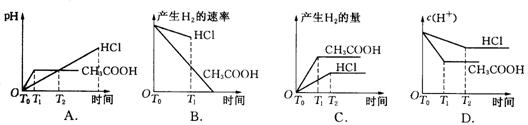
16.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是 ( )
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 |
| |||||||||
| 答案 |
| |||||||||
二、填空题:(共27分)
17.(4分)明矾KAl(SO4)2·12H2O可作净水剂,用离子方程式写出其净水原理: ___。在做油条的面粉中常混入少量的纯碱和明矾, 使得油条内疏松而多孔,用离子方程式表示其原理: __。
18.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(Cl-)>c(H+)>c(NH4+)>c(OH-) ④c(NH4+)>c(Cl-)>c(OH-)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中
c(NH4+)与c(Cl-)的关系:c(NH4+) c(Cl-)。
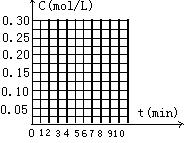
19.在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1O2,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)= mol·L-1·min-1;
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在右边的坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
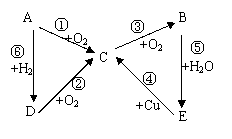 20.(6分)如下图所示,A→E五中含氮物质相互转化的关系图,其中,A、B、C、D在常温下都是气体,B为红棕色。写出各步反应的化学方程式。各步反应的化学方程式 :
20.(6分)如下图所示,A→E五中含氮物质相互转化的关系图,其中,A、B、C、D在常温下都是气体,B为红棕色。写出各步反应的化学方程式。各步反应的化学方程式 :
②_________________________________________
④_________________________________________
⑤_________________________________________
三、实验题:(共22分)
21(11分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答: (1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(6)根据上述各数据,计算烧碱的纯度; 。
22.(11分)氨(NH3)是重要的含氮化合物。1774年该气体由英国普里斯特里利用熟石灰和氯化铵加热反应制成。(1)写出实验室制取氨气的化学方程式 ;
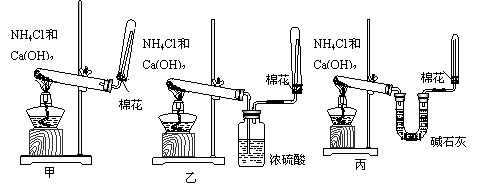 (2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
(2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
 实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)
;
实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)
;
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)
;
(4)该实验装置与实验室制备 气的装置相同.;
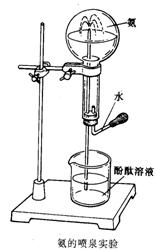
(5)如右图在圆底烧瓶里收集干燥的氨气。挤压胶头滴管中的少量水,使它射入烧瓶中,接着你会观察到的现象是 ,该现象说明氨气具有的性质是 , ;
(6)有同学用氨的喷泉实验装置做喷泉实验,但实验失败,请分析实验失败的可能原因 _。(写出任何一个合理答案即可)。
四、计算题:(共10分)
23.(6分)将标准状况下的22.4LNH3溶解于水,配成1L溶液。设所得溶液的密度为d g/cm3,则该氨水的物质的量浓度为 ,质量分数为 ,溶液中的C(NH3)、C(NH3·H2O)和C(NH4+)的关系为:
24.(4分)将1体积A和3体积B混合,在560 ℃时发生反应:2A(g)+B(g)![]() 2C(g)并达到平衡状态。在相同条件下测得此反应在起始状态和平衡时气体的密度比为9∶10,求A的转化率。
2C(g)并达到平衡状态。在相同条件下测得此反应在起始状态和平衡时气体的密度比为9∶10,求A的转化率。
参考答案
一、选择题:(共16×3分=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | D | C | B | C | C | B | D | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 |
| |||
| 答案 | AC | A | C | AC | A | C |
| |||
二、填空题:(共20分)
17(每小题2分)Al3++3 H2O![]()
![]() Al(OH)3+3H+ 2Al3++
3CO32-=2 Al(OH)3↓+ 3CO2↑
Al(OH)3+3H+ 2Al3++
3CO32-=2 Al(OH)3↓+ 3CO2↑
18.(共5分,每空1分)(1)氯化铵 ① (2) NH4Cl, HCl (3) <, =
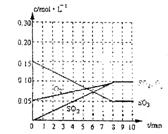 19. (1) 0.0025mol/L. min (1分)
19. (1) 0.0025mol/L. min (1分)
(2) a=0.05 mol/L (2分) 图象如右(1分)
(3) BD(1分)
 20.(每个方程式2分,共6分)
20.(每个方程式2分,共6分)
②4NH3+5O2
![]() 4NO+6H2O
4NO+6H2O
④3Cu+8HNO3
![]() 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
⑤3NO2+H2O=2HNO3+NO
三、实验题(每21小题11分,第22小题11分,共22分)
21.(1)天平、小烧杯、药匙等 (1分)
(2)小烧杯、玻璃棒、250mL容量瓶、胶头滴管(1分)
(3)碱式滴定管 (1分)
(4)左,活塞,右,锥形瓶中溶液的颜色的变化 (各1分)
(5)0.402mol/L (2分) (6)98%(2分)
22.(1)2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O; (2分,条件不写扣1分)
CaCl2 + 2NH3↑+ 2H2O; (2分,条件不写扣1分)
(2)丙;(1分)
(3)将蒸馏水湿润的红色石蕊试纸放在试管口,若试纸变蓝说明NH3已收满;(3分)
(4)氧气;(1分)
(5)红色溶液喷入圆底烧瓶 (1分) ,NH3易溶于水 (1分),NH3与水反应生成碱(1分);
(6)装置气密性差、烧瓶不干燥、选用试剂不当等(答对任何一项即可)(1分)
四、计算题
23. (每空2分)1mol/L (17/10d)% 1mol/L
24.80% (4分)