高二化学第一学期阶段考试
高二化学试卷 (命题人:毛娟)
本卷分第I卷(选择题)和第II卷(非选择题)两部分,满分120分,考试时间100分钟。
可能用到的相对原子质量:H-1 C-12 O-16
第Ⅰ卷 选择题(共64分)
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.下列物质中属于弱电解质的是
A.醋酸 B.氯气 C.蔗糖 D.碳酸钙
2.可逆反应2SO2(g)+O2(g) ![]() 2SO3(g),在体积为2L的密闭容器中进行,如果SO2
2SO3(g),在体积为2L的密闭容器中进行,如果SO2
在某时刻的物质的量为4mol,2min后变为3.6mol,则用O2的浓度变化表示这段时间的反
应速率为 mol·(L·min)—1
A.0.05 B.0.2 C.0.1 D.0.4
3.下列事实能证明氯化氢是共价化合物的是( )
A.氯化氢极易溶于水 B.液态氯化氢不导电
C.氯化氢不易分解 D.氯化氢在水中可以电离
4.在100℃时,水的离子积为1×10-12,此时纯水中c(H+)=1×10-6,pH=6。则纯水在该温度下显
A.酸性 B.碱性
C.中性 D.无法确定
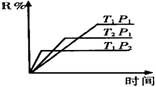
![]() 5.在密闭容器中进行下列反应:M(气)+N(气) R(气)+2L此反应符合下面图象,下列叙述正确的是
5.在密闭容器中进行下列反应:M(气)+N(气) R(气)+2L此反应符合下面图象,下列叙述正确的是
A.正反应吸热,L是气体
B.正反应吸热,L是固体或液体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
6.已知在25℃、101k Pa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ的热量。表示上述反应的热化学方程式正确的是
A.C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(g);△H= -48.40 kJ·mol—1
O2(g)===8CO2(g)+9H2O(g);△H= -48.40 kJ·mol—1
B.C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l);△H= -5518 kJ·mol—1
O2(g)===8CO2(g)+9H2O(l);△H= -5518 kJ·mol—1
C.C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l);△H= +5518 kJ·mol—1
O2(g)===8CO2(g)+9H2O(l);△H= +5518 kJ·mol—1
D.C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l);△H= -48.40
kJ·mol—1
O2(g)===8CO2(g)+9H2O(l);△H= -48.40
kJ·mol—1
二、不定项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项)
7.下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.相同浓度时导电能力醋酸强
8. 反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L—1,对此反应速率的表示,正确的是
A.用A表示的反应速率是0.4 mol·L—1·min—1
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.在2 min末的反应速率,用B表示是0.3 mol·L—1·min—1
D.在这2 min内用B和C表示的反应速率的值都是逐渐减小的
|
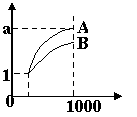 9.pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
9.pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.若1< a < 4,则A、B都是弱酸。
10.人体血液的正常pH约为7.35~7.45,若在外界因素
作用下pH突然发生较大的改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于
人体体液的缓冲系统中存在如下平衡:
![]()
![]() H++HCO3— H2CO3 CO2+H2O
H++HCO3— H2CO3 CO2+H2O
![]()
![]() H++PO43— HPO42— H++
HPO42— H2PO4—
H++PO43— HPO42— H++
HPO42— H2PO4—
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行正常呼吸活动时,CO2进入血液,会使平衡向左移动,c(H+)略增大,pH值改变很小
11.下列反应的离子方程式正确的是
A.硫酸与氢氧化钡溶液反应: H++SO42—+Ba2++OH—=BaSO4↓+H2O
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH-=H2O
D.碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O
![]() 12.化学反应
3A(g)+Q(g) 2R(g)+2S(g)
达平衡后,增大压强,下列叙述正确的是
12.化学反应
3A(g)+Q(g) 2R(g)+2S(g)
达平衡后,增大压强,下列叙述正确的是
A.正、逆反应速率都增大,平衡不发生移动
B.正、逆反应速率都增大,平衡向正反应方向移动
C.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
![]() 13.某温度下,反应H2(g)+I2(g) 2HI(g) △H< 0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是
13.某温度下,反应H2(g)+I2(g) 2HI(g) △H< 0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是
A.恒温压缩体积,平衡不移动,颜色加深 B.恒压迅速充入HI,开始时正反应速率减小
C.恒容,升温正反应速率减小 D.恒容,充入H2,I2的百分比含量降低
14.25℃时,pH=3的盐酸中由水电离出的H+离子浓度是pH=5的盐酸中由水电离的H+
离子浓度的多少倍
A.10—2 B.102 C.2 D.12
15.两学生用同一瓶标准盐酸滴定同一瓶氢氧化钠溶液,甲将锥形瓶用NaOH待测液润洗后,用经水洗涤后的碱式滴定管移取碱液于锥形瓶中。乙则接着以甲用过的碱式滴定管移取碱液于刚用水洗过的锥形瓶中(锥形瓶中留有较多的蒸馏水)其它操作的读数均正确。则
A.甲操作有错 B.乙操作有错
C.甲测定数值一定比乙小 D.乙实际测得的数据准确
16.下列说法不正确的是
A.体系有序性越高,熵值就越低
B.知道了某过程有自发性之后可预测过程完成的快慢
C.吸热反应不可以自发进行
D.同种物质气态时熵值最大
Ⅱ卷 (非选择题56分)
二、(本题包括2小题,共19分。)
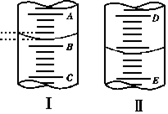 17.( 4分)(1)图1表示10mL量筒中液面的位置,A与B, B与C刻度间相差1mL, 如果刻度A为4,量筒中
17.( 4分)(1)图1表示10mL量筒中液面的位置,A与B, B与C刻度间相差1mL, 如果刻度A为4,量筒中
液体的体积是________mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) _。
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
18.( 11分)某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250ml溶液,需要的主要仪器有 。
(2)滴定
① 用 量取10.00ml待测液。
② 用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,加入几滴酚酞,边滴边摇动锥形瓶,眼睛注视 ,直到 时停止滴定
(3)数据处理
| 实验次数编号 | 盐酸溶液体积 V(ml) | 氢氧化钠溶液体积 V(ml) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 ,烧碱的纯度为 。
(4下列操作,会导致实验结果偏低是 (填序号)。
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来
三、(本题包括2小题,共21分)
19.( 10分)有pH=1的盐酸、硫酸、醋酸三瓶溶液:(用>、<、= 表示,下同)
(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是 ;反应过程中放出H2的速率依次为υ/1、υ/2、υ/3,则其关系是 。
20.(11分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:
![]() 2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
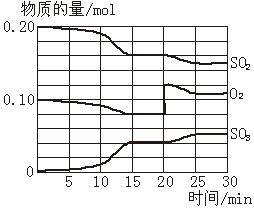 |
(1)写出该反应的化学平衡常数表达式:K= ;
降低温度, K值 ;SO2的转化率_____ __,化学反应速度____ ___。
(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间段是____ ___。
(3)反应进行至20 min时,曲线发生变化的原因是________ ______________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
四、(本题包括2小题,共16分。)
21.(7分))在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比。
22.(9分)室温下,有pH=2的硫酸溶液100ml,欲使其pH变为3,可向其中加入水、碱溶液或更稀的酸。请计算(混合后溶液体积的变化忽略不计):
⑴加入水的体积。
⑵加入0.1mol/L的NaOH溶液的体积。
⑶加入pH=4的硫酸的体积。
高二化学试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | A | B | C | C | B | B | BD |
| 题号 | 9 | 19 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | CD | C | B | A | C | A | AD | BC |
17.(1)3.2(2)D
18.(1)托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶(有无量筒均可)
(2)①碱式滴定管
②锥形瓶中颜色变化;溶液中红色突然褪去或突然有红色变为无色
(3)0.4020mol·L-1;98.05%
(4)①②⑥
19.(1)C3>C1>C2或C3>C1=2C2 (2)V3>V1=V2
(3)n1=n3>n2或n1=n3=2n2 (4)v1=v2=v3;v´1=v´2<v´3
20.解析:(1)K=
降温,K值增大,平衡向正反应方向移动,SO2的转化率增大,化学反应速率降低。
(2)反应进行15 min时,SO2、O2、SO3的物质的量均不发生变化,说明反应达到了平衡状态。
(3)反应进行至20 min,O2的物质的量发生突变,说明此时增加了O2的量。
答案:(1)增大 减小
(2)15~20 min,25~30 min
(3)增加了O2的量 ab
21.设燃烧后共生成二氧化碳x,混合气体中甲烷的物质的量为a,CO的物质的量为b
CaCO3 ~ CO2
100 1
50g x x = 0.5 mol
![]() 890 kJ/mol
a + 566/2 kJ/mol b = 262.9
kJ
890 kJ/mol
a + 566/2 kJ/mol b = 262.9
kJ
a + b = 0.5
解出a = 0.2 mol b = 0.3 mol
a/b = 2/3
22⑴900ml ⑵8.9ml ⑶1000ml
年级均分为99分,偏高,题目偏易