高二化学第一期半期检测题
高二化学试题
(考试时间:100分钟 满分:100分)
题 号 | 一 | 二 | 三 | 四 | 总 分 |
| 得 分 | |||||
| 评分人 |
可能用到的相对原子质量:H 1 C 12 O 16 Cu 64
第Ⅰ卷 选择题(共50分)
一、选择题( 本大题共10小题,每小题只有一个正确答案,每小题2分,共20分;将正确答案的序号填在后面的答题卡内。)
1、氨是一种重要的致冷剂,原因是
A、氨易溶于水 B、液氨气化时吸收大量的热,使周围的温度迅速降低
C、它在常温下是气体 D、氨分子结构呈三角锥,是极性分子
2、下列气体中,既能用P2O5干燥,又能用生石灰干燥的是
A、NH3 B、SO2 C、NO D、NO2
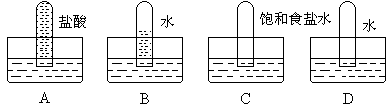
3、四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是
4、本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是
A、化学反应速率理论是研究怎样在一定时间内快出产品
B、化学平衡理论是研究怎样使用有限原料多出产品
C、化学反应速率理论是研究怎样提高原料转化率
D、化学平衡理论是研究改变外界条件对反应物的转化率有什么影响
5、下列说法正确的是
A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B、蔗糖、硫酸钡和氨水分别属于非电解质、强电解质和弱电解质
C、工业上合成氨采用高压、高温和使用催化剂都可用平衡移动原理解释
D、除去NO中有少量的NO2可用水洗涤后再干燥
6、在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 2Z(g) 不能说明该反应已达到平衡的标志是
2Z(g) 不能说明该反应已达到平衡的标志是
A、容器内X、Y、Z的物质的量浓度之比为1︰2︰2
B、容器内各物质的物质的量浓度不随时间变化
C、容器内气体的压强不随时间变化
D、单位时间消耗0.1mol X同时消耗0.2mol Z
7、氯气是一种重要的工业原料。工业上利用反应3Cl2 + 2NH3 = N2 + 6 HCl检查氯气管
道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟 B、该反应属于复分解反应
C、该反应利用了Cl2的强氧化性 D、生成1molN2有6mol电子转移
8、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体仍无沉淀生成,则通入的气体可能是:
A、CO2 B、NH3 C、Cl2 D、NO2
9、下列叙述正确的是
A、空气中的NO是造成光化学烟雾的主要因素
B、二氧化氮溶于水生成硝酸,因此二氧化氮是硝酸的酸酐
C、雷雨时,可增加土壤的硝酸盐氮肥的变化属于氮的固定
D、白磷可用于制造安全火柴
10、学校运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生化学反应:
5 KClO3 + 6 P = 3 P2O5 + 5 KCl 。下列有关该反应的叙述中,正确的是
A、反应中红磷是氧化剂
B、发令时产生的白烟全是KCl固体
C、“火药”中的红磷可以用白磷代替
D、反应中消耗2 mol P时,转移电子的物质的量为10 mol
二、选择题( 本大题共10小题,每小题只有一个正确答案,每小题3分,共30分;将正确答案的序号填在后面的答题卡内。)
11、20℃时,H2S的饱和溶液,浓度约为0.1mol/L,其电离方程式为:第一步 H2S ![]()
H+ + HS─;第二步 HS─ ![]() H+ + S2─。若要使该溶液的pH增大的同时,c(S2─)减小,现有以下措施:①加入NaOH溶液;②加入KCl溶液;③通入SO2气体; ④加入蓝矾晶体;⑤加入浓盐酸。其中采用的措施正确的是
H+ + S2─。若要使该溶液的pH增大的同时,c(S2─)减小,现有以下措施:①加入NaOH溶液;②加入KCl溶液;③通入SO2气体; ④加入蓝矾晶体;⑤加入浓盐酸。其中采用的措施正确的是
A、①③⑤ B、②④⑤ C、②③ D、③④⑤
12、取相同物质的量浓度、相同体积的(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种溶液,分别滴加相同物质的量浓度NaOH溶液,直至刚好完全反应生成磷酸盐,三种溶液消耗的NaOH溶液的体积比是
A、1︰2︰3 B、3︰2︰1 C、1︰1︰1 D、6︰3︰2
13、 6.4克铜与足量的浓硝酸反应(硝酸的还原产物只有一种),生成的气体被饱和的氢氧化钠溶液完全吸收,生成NaNO3和NaNO2,则亚硝酸钠的物质的量为
A、0.2mol B、0.3mol C、 0.1mol D、0.5mol
14、下列某无色溶液中,能大量共存的离子组是
A、NH4+、NO3-、I-、H+ B、NO3-、Na+、Ba2+、Ag+
C、Cl-、Cu2+、SO42-、NO3- D、NH4+、NO3-、K+、OH-
15、将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(g)+B(g)= 2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是
A、用物质 A 表示的反应的平均速率为 0.6 mol·L-1·s-1
B、用物质 B 表示的反应的平均速率为 0.3 mol·L-1·s-
C、2 s 时物质 A 的转化率为70%
D、2 s 时物质 B 的浓度为 0.7 mol·L-1
以下各题中的△H<0表示可逆反应的正反应是放热反应,△H>0表示可逆反应的正反应是吸热反应。
16、某温度下,在一容积可变的恒压密闭容器里,反应3A(g) ![]() B(g) + 3C(g) △H<0,
B(g) + 3C(g) △H<0,
达到平衡时,A、B和C的物质的量分别为6mol、2mol、6mol。在保持温度和压强不变的条
件下,下列说法正确的是
A、充入1 mol氦(He)(He与容器中气体不反应),平衡将向逆反应方向移动
B、充入A、B、C各2 mol,平衡将向正反应方向移动
C、将A、B、C各减少1 mol,C的百分含量增加
D、加入一定量的A气体达平衡后,C的百分含量一定增加
17、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化图象(图中P表示压强,T表示温度,n表示物质的量):
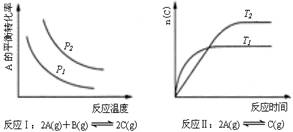
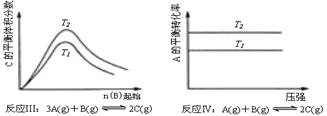
根据以上图象判断,下列叙述不正确的是
A、反应Ⅰ:△H>0,P2<P1
B、反应Ⅱ:△H<0,T1>T2
C、反应Ⅲ:△H>0,T2>T1
D、反应Ⅳ:△H<0,T2<T1
18、20℃时,将10ml0.1mol/L Na2S2O3溶液和10ml0.1mol/L H2SO4溶液混合,2分钟后溶液中明显出现浑浊。己知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反应要看到明显浑浊,需要的时间是
A、15秒 B、20秒 C、40秒 D、50秒
19、在室温下,下列等体积的酸和碱溶液混合后,pH一定小于7的是
A、pH=3的HNO3与pH=11的KOH溶液
B、pH=3的盐酸与pH=11的氨水
C、pH=3的硫酸与pH=11的NaOH溶液
D、pH=3的醋酸与pH=11的Ba(OH)2溶液
20、为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg![]() . 下列叙述正确的是
. 下列叙述正确的是
①任何温度下,水的AG等于0
②溶液的AG越小,酸性越强
③常温下,0.1mol/L盐酸的AG=12
④25℃时,某溶液的AG=-10,其pH=10
A、①② B、②④ C、①③ D、③④
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第II卷 非选择题(共50分)
三、填空题(本大题共6小题,共40分)
 21、(8分)A是一种白色晶体,它与浓NaOH溶液共热放出无色气体B。用圆底烧瓶收集干燥的B。按右图装置仪器,挤压胶头滴管时,可以得到蓝色喷泉。A与浓H2SO4反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按右图装置仪器,挤压胶头滴管时可以得到红色喷泉,而B、C混合会产生白烟。
21、(8分)A是一种白色晶体,它与浓NaOH溶液共热放出无色气体B。用圆底烧瓶收集干燥的B。按右图装置仪器,挤压胶头滴管时,可以得到蓝色喷泉。A与浓H2SO4反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按右图装置仪器,挤压胶头滴管时可以得到红色喷泉,而B、C混合会产生白烟。
|
![]() (2)检验气体B的方法是
(2)检验气体B的方法是
。
(3)写出A与浓NaOH溶液加热时反应的离子方程式:
|
(4)写出实验室以A为原料制取气体B的化学方程式:
。
22、(4分)某无色混合气体可能由Cl2 、O2 、N2、NH3、NO、CO2、HCl中的一种或几种组成。室温下将该混合气体通过足量的浓硫酸,体积减少,剩余气体再通过足量碱石灰,体积又减少,余下的气体接触空气后立即变色。则原混合气体中一定含有的气体是 ;可能含有的气体是 。
23、(8分)现有A、B、C、D、E、F、G、H、I九种常见的物质,其中常温下A、B、F、H、I为气体,E、I为单质,G溶液呈蓝色,现代医学研究表明F分子在人体内有独特功能,它与血红蛋白结合的能力比CO更强。H分子中含有10个电子,A、B最简式相同,A的相对分子质量大于B的相对分子质量。A~I九种物质间的相互转化关系如下。(图中反应条件略去)
 |
试回答以下问题:
(1)写出H分子的电子式 。
(2)写出反应①的化学方程式: 。
反应②的离子方程式: 。
(3)实验室若要测定B的相对分子质量,适宜的条件是 。
24.(8分)(1)简述PH试纸的使用方法
。
(2) 某温度时,水的离子积为KW=1×10-13,则该温度 (填<、>、=)25℃;将此温度下pH=12的苛性钠溶液aL与pH=1的稀硫酸bL混合,若混合溶液的 pH=2,则a:b= 。
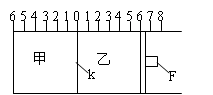 25、(6分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,活塞F右边与大气相通;甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
25、(6分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,活塞F右边与大气相通;甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);经过一段时间反应达到平衡。回答下列问题:
2C(g);经过一段时间反应达到平衡。回答下列问题:
(1)可根据 的现象来判断甲、乙容器中的反应
已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol。
26.(6分)在一定温度下, 1molN2和3molH2发生下列反应:
N2(g)+ 3H2(g)![]() 2NH3(g)
△H<0
2NH3(g)
△H<0
(1)若在起始体积都是1L的定压密闭容器中和定容密闭容器中建立反应,先达到平衡的
是 密闭容器, H2的转化率高的是 密闭容器(填定压或定容)
(2)若在上述定压容器中反应达到平衡时,平衡混和物中NH3的体积分数是a。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使反应达到平衡后平衡混和物中NH3的体积分数同样是a。则x、y、z满足的条件是 。
四、计算题(本大题只有1小题,共10分)
27、(10分)将V mL NO和NO2的混合气体通过水吸收后得到a mL无色气体A,将此无色气体A与等体积氧气混合,再通过水充分吸收后,收集到20 mL无色气体B(气体的体积是在相同的条件下测定的)。
⑴A气体是 ,B气体是 。
⑵A气体的体积是 mL。
⑶V值的范围是 。
高二化学试题答案
一、二 选择题(1至10题每题2分,11至20题每题3分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | C | C | D | A | B | A | C | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | C | C | B | D | C | A | A | D | C |
三、填空题(本大题共6小题,共40分)
21、(计8分)(1)A NH4Cl 、C HCl (各1分)
(2)用玻璃棒沾湿润的红色石蕊试纸接触气体C,如试纸变蓝,则证明是NH3 。(2 分)
(3)NH4+ + OH- ![]() NH3↑
+ H2O ( 2 分)
NH3↑
+ H2O ( 2 分)
(4) 2NH4Cl + Ca(OH)2 ![]() 2NH3↑ + 2H2O
+ CaCl2 (2分)
2NH3↑ + 2H2O
+ CaCl2 (2分)
22、(计4分)NH3、NO 、CO2 ; N2 (每空2分,有错不给分)
23、(计8分)(1)略
(2)3NO2+H2O=2HNO3+NO 3Cu+8H++2NO3-=3Cu2++2NO↑+ 4H2O
(3)高温、低压 (每空2分,(3)中1个条件给1分)
24、(计8分)(1)取一张pH试纸放于洁净的玻璃片上,然后用洁净的玻璃棒沾取试液滴在pH试纸中部,半分钟后与标准比色卡对照读出pH值。 (3分)
(2)> (2分)
(3)9:11 (3分)
25、(计6分) (1)K、F不再移动 (2)0<a<2 (3)1mol (每空2分)
26、(计6分)(1)定压 (2分 ) 定压 ( 2分)
(2)x:y=1:3 ,z≥0 ,x,y,z不同时为0 (2分)
四、计算题(本大题1个小题,共10分)
27、(1) NO;O2 (每空2分)
(2) 80mL (3分)
(3)80<V <240 (3分)