高二化学第一次月考试卷
命题人:李新朵
相对原子质量:H—1 C—12 Na—23 O—16 P—31 Si—28 S—32 Cu—64
第I卷(选择题,共51分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个正确答案)
1..起固定氮作用的化学反应是( )
A.N2和H2在一定条件下反应生成NH3 B.NO与O2反应生成NO2
C.NH3催化氧化生成NO D.由NH3制NH4HCO3和(NH4)2SO4
2.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
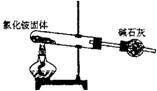


A B C D
3.氨水中所含的分子和离子可能有:①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH—其中正确的组合是( )
 A.①②③
B.②③④⑤
C.②③④⑤⑥
D.①②③④⑤⑥
A.①②③
B.②③④⑤
C.②③④⑤⑥
D.①②③④⑤⑥
4、实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是( )
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
5.五氧化二磷不仅是一种强干燥剂,而且有很强的脱水性,向浓硝酸中加入过量的P2O5,能生成一种含氮化合物M,则M最可能是( )
A. N2 B.NO2 C.NO D.N2O5
6.下列各组离子,在强碱性溶液中可以大量共存的是( )
A.K+、Na+、HSO![]() 、Cl-
B.Na+、Ba2+、AlO
、Cl-
B.Na+、Ba2+、AlO![]() 、NO
、NO![]()
C.NH![]() 、K+、Cl-、NO
、K+、Cl-、NO![]() D.K+、Na+、ClO-、S2-
D.K+、Na+、ClO-、S2-
7.能正确表示下列反应的离子方程式是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3- +OH- = CO32 -+H2O
B.醋酸钠溶液和盐酸混合:CH3COONa+H+ = CH3COOH+Na+
C.盐酸滴入氨水中:H++OH- = H2O
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42 -+Ba2++2OH- = Cu(OH)2↓+BaSO4↓
8.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
9.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3 ②NO2,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )
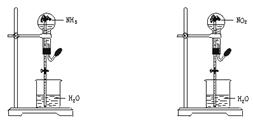
A.①>② B.①<② C.①=② D.不能确定
10. 38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4毫升(标准状况),反应消耗的HNO3的物质的量可能是( )
A.1.0×10-3摩尔 B.1.6×10-3摩尔 C.2.2×10-3摩尔 D.2.0×10-3摩尔
11. 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物.当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是( )
A.NO2 B.NO C.N2O D.N2
12.以下关于化学反应速率的论述中正确的是( )
A.化学反应速率可用某时刻生成物的物质的量来表示
B.同一反应中,用反应物或生成物表示的化学反应速率数值相同
C.化学反应速率是指反应进行的时间内反应物浓度的减少或生成物浓度的增加
D.可用单位时间内氢离子物质的量浓度变化来表示NaOH和H2SO4的反应速率
![]() 13.反应
4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
13.反应
4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A. V(O2)=0.01mol.L-1.s B. V(NO)=0.008mol.L-1.s-1
C. V(H2O)=0.006mol.L-1.s-1 D. V(NH3)=0.002mol.L-1.s-1
![]() 14.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,
14.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,
在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的( )
A.增加CO的物质的量
 B.将容器的体积缩小一半
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
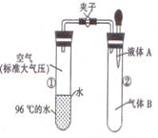
15、如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的( )
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
16、硫酸铵在强热下分解,生成氨气、二氧化硫、氮气和水,反应中生成的氧化产物和还原产物的分子个数比为多少( )
A、3:1 B、1:3 C、1:1 D、4:3
17、木炭屑与浓HNO3共热,产生的气体等分为①和②两份,将第一份气体先导入适量蒸馏水中再导入石灰水中,将第二份气体直接导入石灰水中,则石灰水的变化可能是( )
A.①不变浑浊②变乳白色 B.①变乳白色②不变浑浊
C.①变乳白色②变乳白色 D.①不变浑浊②变浅黄色
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)
 第一次月考试卷
第一次月考试卷
高二化学
选择题答题表:
一、选择题:(本题包括17小题,每小题3分,共51分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
第II卷(非选择题,共49分)
二、填空题:(本题包括5小题,共49分)
18.(6分)氨气电子式为 ,结构式为 ,铵盐与碱反应均能生成氨气,写出实验室利用此原理制取氨气的反应的化学方程式____________________________;利用相同的发生装置还可制取_______________(填一种气体的分子式),简述如何检验集气瓶氨气是否已收集满了_________________
_______________________________________________________________________________________。
19. (8分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
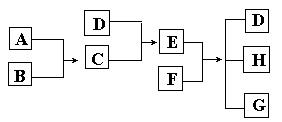
⑴ D的化学式(分子式)是_____________,E的化学式(分子式)是_____________。
⑵ A和B反应生成C的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是___________________________________。
20.(6分)配平下列化学方程式并将其系数填在答题卡上:
(1): Fe + HNO3 = Fe(NO3)3 + NH4NO3 + H2O
(2): NO2 + NaOH = NaNO2 + NaNO3+ H2O
(3) SO32- + MnO4- + H+ — Mn2+ + SO42- + H2O
21.(8分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入VmL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
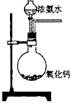
22.(16分)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
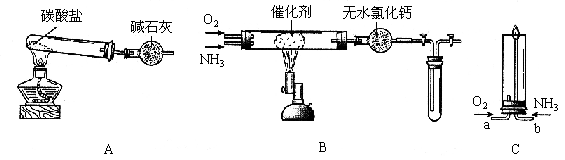
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是__________;碱石灰的作用是_______________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
<1>氨催化氧化的化学方程式是___________________________________________;
试管内气体变为红棕色,该反应的化学方程式是____________________________。
<2>停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因________________________________________________________________
_______________________________________________________________________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
<1>两气体通入的先后顺序是_______________________________________________,其理由是________________________________________________________________________________________
_____________________________________。
<2>氨气燃烧的化学方程式是___________________________________________。
三.计算题:(本题包括1小题,共5分)
23.(5分)氨氧化法制硝酸的生产过程中,如果由氨制一氧化氮的转化率为96% ,而一氧化氮转化为硝酸的转化率为92% 。现用10 t 氨按上述情况可制得50%的硝酸多少吨?
高二化学参考答案
一、选择题:(本题包括17小题,每小题3分,共51分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | B | D | B | D | B | D | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
| 答案 | C | C | D | D | C | C | B | B |
|
二、填空题:(本题包括5小题,共49分)
18.(6分)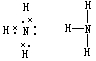
![]() O2
O2
19. (8分)(1)NH3 NH4Cl (2)
(3)
20.(6分)(1):8 30 8 3 9
(2):2 2 1 1 1
(3) 5 2 6 2 5 3
21.(8分)(1)5.8 5.4 (2)![]() (3)57.8
(3)57.8
22.(16分)
(1)① (NH4)2CO3[或NH4HCO3] ② 吸收水和二氧化碳
|
② 2NO2(g)
![]() N2O4(g)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4。
N2O4(g)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4。
(3)①先通入O2,后通入NH3。若先通氨气,氨在空气中不能点燃,逸出造成污染。
②4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
23.(5分)略