高二化学第一学期月考试题
化学X科
时间:120分钟 总分:150分 命题人:叶逢跃
原子量:Cu-64 Ag-108 N-14 H-1 O-16
一、选择题(每题只有一个正确选项符合题意,每题3分,共9题27分)
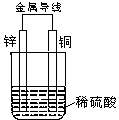
1、锌锰干电池在放电时,电池总反应方程式可以表示为:
Zn+2MnO2+2NH4+ Zn2++Mn2O3+2NH3+H2O此电池放电时,正极上发生反应的物质是( )
A.Zn B.碳棒 C.MnO2和NH4+ D.Zn2+和NH4+
2、在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )
A.锌作阳极,镀件作阴极,溶液含有锌离子 B.铂作阴极,镀件作阳极,溶液含有锌离子
 C.铁作阳极,镀件作阴极,溶液含有亚铁离子 D.锌用阴极,镀件作阳极,溶液含有锌离子
C.铁作阳极,镀件作阴极,溶液含有亚铁离子 D.锌用阴极,镀件作阳极,溶液含有锌离子
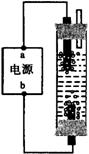
3、关于如图所示装置的叙述,正确的是( )
A.锌是负极,锌片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
4、X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
5、用石墨为电极材料电解时,下列说法正确的是( )
A.电解NaOH溶液时,溶液浓度将减小,pH不变
B.电解H2SO4溶液时,溶液浓度将增大,pH不变
C.电解Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解NaCl溶液时,溶液浓度将减小,pH不变
 6、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
6、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
7、下列各变化中属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层 B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 D.浓硝酸比稀硝酸更能氧化金属铜
8、100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )
A. 加入适量的6mol/L的盐酸 B. 加入数滴氯化铜溶液
C. 加入适量蒸馏水 D. 加入适量的氯化钠溶液
9、在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e→Ag在电极上放电,其析出铜的质量为2.56g,则析出银的质量为 ( )
A.1.62g B.6.48g C.8.64g D.12.96g
二、选择题(每题有1~2个选项符合题意,每题4分,共10题40分)

 10、据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
10、据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O,则下列说法错误的是( )
A放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
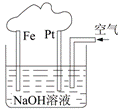 11、有关右图装置的叙述正确的是( )
11、有关右图装置的叙述正确的是( )
A.这是一个原电池装置
B.这是电解NaOH溶液的装置
C.该装置中Fe为阴极,
电极反应为: Fe-3e-+ 3OH-=Fe(OH)3
D.该装置中Pt为正极,电极反应为: O2 + 2H2O + 4e-=4OH-
12、将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A. 1∶2∶3 B. 3∶2∶1 C. 6∶3∶1 D. 6∶3∶2
13、为保护地下钢管不受腐蚀,可采用的方法是( )
A. 将它与直流电源的负极相连接 B. 将它与交流电源相连接
C. 将它与Cu板相连接 D. 将它与Zn板相连接
14、关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
15、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A. 利用电池外壳的金属材料 B. 不使电池中渗泄的电解液腐蚀其他物品
C. 回收其中石墨电极 D. 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
 16、如右图所示,在一U型管中装入含有紫色石蕊的
16、如右图所示,在一U型管中装入含有紫色石蕊的
Na2SO4试液,通直流电,一段时间后U型管内会形成一
个倒立的三色 “彩虹”,从左到右颜色的次序是( )
A.蓝、紫、红
B.红、蓝、紫
C.红、紫、蓝
D.紫、红、蓝
17、铁在下列情况下腐蚀最快的是( )
A.铁放在海水中 B.铁和锌连接放入水中
C.铁和锡连接放入海水中 D.铁和锡连接放入淡水中
18、下列有关纯铁的描述正确的是( )
A.熔点比生铁低 B.与同浓度盐酸反应生成H2的速率比生铁快
C.在潮湿的空气中比生铁容易被腐蚀 D.在冷的浓硫酸中可发生钝化
19、用质量均为100g的铜作电极,电解AgNO3溶液,电解一段时间后,两极质量相差28g,此时阳极质量为( )
A. 121.6g B. 86g C. 93.6g D. 89.6g
三、填空题(共4题60分)
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe → Cu | +0.78 |
| Zn | Zn → Cu | +1.10 |
| A | Cu → A | -0.15 |
| B | B → Cu | +0.3 |
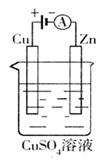
20、(15分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连接浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如右表所示:
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数
越 (填“大”、“小”)。
Zn、A、B三种金属活动性由强到弱的顺序是 。
(2)Cu与A组成的原电池, 为负极,此电极反应式为 。
(3)A、B形成合金,露置在潮湿空气中, 先被腐蚀。
21、(15分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624KJ(25℃时),
N2H4完全燃烧反应的热化学方程式是 。
 (2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
22、(8分)银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。工作时原电池的总反应是:Ag2O+Zn+H2O===2Ag+Zn(OH)2,根据上述变化判断:
(1)原电池的正极是___________。 (2)工作时原电池两极反应式为:
负极__________ __ ___,正极__________ ____
(3)工作时原电池负极附近的pH值________(填“增大”、“不变”、“减小”)
23、(19分)市场上出售的“热敷袋”其主要成分为铁屑、炭粉、木屑和少量氯化钠、水等。热敷袋启用之前用塑料袋使其与空气隔绝,启用时打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量铁锈存在。请回答下列问题。
(1)热敷袋产生热量的来源是____________________________________________。
(2)炭粉的主要作用是__________________________________________________。
(3)加入NaCl的主要作用是_____________________________________________。
(4)写出生成铁锈的有关方程式————————————————————、———————————————————————————、————————————————————————————————、—————————————————————————、——————————————————————————————(按生成过程分步写,不可合并成总式)
四、计算题(共2题23分)
24、(14分)有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
25、(9分) (1)已知在常温下,FeS的Ksp=6.25×10-18,求此温度下FeS的溶解度。(设饱和溶液密度为1g·mL-1) (2)又知常温下,H2S饱和溶液中,H+与S2-间存在着c(H+)2c(S2-)=1.0×10-22。在该温度,将足量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol·L-1,应调节溶液的pH值为多少?
 答卷
答卷
第一卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
| 答案 |
|
|
|
|
|
|
|
|
| |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第二卷
三、填空题
20.(15分) (1)_____________、__________________________________________________
(2) __________________________________________________、__________________________________________________
(3) ______________________
21.(18分)(1)_______________________________________________________________________________________
(2)_________________________________________ __________________________________________________
(3) ①____________________ ②__________L
(4)__________________________
22.(8分)(1)_____________ (2) ___________________________________________、__________________________________ (3)____________
23.(1)_______________________________________________________________________________________
(2)_______________________________________________________________________________________
(3)_______________________________________________________________________________________
(4)__________________________________________________、________________________________________________、
__________________________________________________、________________________________________________
__________________________________________________
四、计算题
24
25
答案:1、C 2、A 3、D 4、A 5、C 6、D 7、B 8、B 9、A 10、AD 11、D 12、AD
13、B 14、D 15、C 16、C 17、D 18、C
19、(1)大,Zn>B>A (2)Cu,Cu-2e-=Cu2+ (3)B
20、(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-624KJ/mol
(2)O2+4H2O+4 e-=4OH- N2H4-4 e-+4 OH-=N2+4H2O
(3)Cu2++2e-=Cu 112L
(4)ClO-+2NH3=N2H4+Cl-+H2O
21、(1)Ag2O
(2)负:Zn-2e+2OH-===Zn(OH)2
正:Ag2O十H2O十2e===2Ag十2OH-
(3)变小
22、⑴热敷袋内发生的是原电池反应,放出的热量是铁被氧化时释放的。(2分)(2)其中铁做负极,炭粉为正极,(2分)(3)NaCl与水构成了电解质溶液。(2分)(4)热敷袋中主要发生以下反应:Fe-2e-==Fe2+,;2H2O+O2+4e--==4OH--;Fe 2++2OH--==Fe(OH)2 ;4Fe(OH)2+O2 +2H2 O==4Fe(OH)3 ;2Fe(OH)3 ==Fe2O3+3H2O。(5分)
24、 (M)=n[M(NO3)x·yH2O]=![]() =0.005mol
=0.005mol
![]() M的化合价=
M的化合价=![]() 所以x=2
所以x=2
根据64+2(14+48)+18y=242 得y=3
![]() (2)电解总反应为:
(2)电解总反应为:
2M(NO3)2+2H2O 2M + 4HNO3 +O2↑
2 4
0.005mol n
n(HNO3)=![]()
![]()
pH = -lg10-1 = 1
25. S=2.2×10-6g;(2)pH=2.4