高二化学第一学期期中形成性测试卷
(理科)
| 题号 | 一、选择题 | 二、填空题 | 三、实验题 | 四、计算题 | 总分 |
| 满分 | 48 | 24 | 20 | 8 | 100 |
| 实得分 |
(相对原子质量:K-39 Cl-35.5 O-16 H-1)
一、选择题(每题只有一个正确答案,3分×16=48分)
1、氮气是一种很不活泼的气体,其根本原因是
A.氮元素的非金属性较弱 B.氮原子半径小,核对外层电子吸引力较强
C.氮气为双原子分子 D.使N≡N键断裂需要很高的能量
2.已知下列事实:①硝酸的酸性比磷酸强;②硝酸显强氧化性,磷酸不显强氧化性;③氮气与氢气可以化合,磷与氢气很难化合;④氨气比磷化氢稳定。其中能够说明氮元素的非金属性比磷元素强的是
A.① ② ③ B.① ② ④ C.① ③ ④ D.② ③ ④
3.在一密闭容器中进行下列反应:2SO2+O2![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是
A.SO2为0.4mol/L,O2为0.2mol/L B.SO2为0.29mol/L
C.SO2,SO3均为0.15mol/L D.SO3为0.4mol/L
4.下列各组物质中,互为同素异形体的是
A.氕和氘 B.O2和O3 C.CO和CO2 D.氯水和液氯
5.实现下列变化,必须加入氧化剂或还原剂的是
![]()
![]() A.NO2 HNO3+NO
B.NH4+ NH3
A.NO2 HNO3+NO
B.NH4+ NH3
![]()
![]() C.NH3 NO
D.P2O5 H3PO4
C.NH3 NO
D.P2O5 H3PO4
6.为了除去铝表面的铜镀层可选用试剂是
A.稀HNO3 B. 浓HNO3 C.浓H2SO4 D。浓HCl
7.以下贮存物质的方法正确的是:
A.少量白磷贮存在二硫化碳中 B.水玻璃贮存在带玻璃塞的玻璃瓶中
C.少量碘贮存在酒精中 D.浓硝酸贮存在棕色的玻璃瓶中
根据以下叙述回答8和9题。
把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),5min末已生成0.1mol/L的W,若测知以Z浓度变化来表示的反应平均速率为0.01mol·L-1·min-1,则
8.上述反应中Z气体的化学计量数n的值是
A.1 B.2 C.3 D.4
9.上述反应在5min末时, Y的转化率是
A.20% B.25% C.33% D.50%
10.在一体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g)![]() 3C(g)+D(g),平衡时C的浓度为a mol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为a mol·L-1的是
3C(g)+D(g),平衡时C的浓度为a mol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为a mol·L-1的是
A.4 mol A+2 mol B B.2 mol A+1 mol B+3 mol C+1mol D
C.3 mol C+1 mol D D.3 mol C+1 mol B+1 mol D+1mol A
11.有可逆反应2A(g) +3B(g) ![]() C(g) + 4D(g)达到平衡状态的标志是
C(g) + 4D(g)达到平衡状态的标志是
A.此时各物质的浓度CA:CB:CC:CD==2﹕3﹕1﹕4
B.在单位时间内消耗了2mol A同时生成了3mol B
C.混合气体的平均相对分子质量和压强不再改变
D.在单位时间内消耗了1mol C同时生成了3mol B
12.,反应4NH3(g)+5O2(g)
![]() 4NO(g)+6H2O(g),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(x)可表示为: A.υ(NH3)=0.010mol/(L·s)
B.υ(O2)=0.001mol/(L·s)
4NO(g)+6H2O(g),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(x)可表示为: A.υ(NH3)=0.010mol/(L·s)
B.υ(O2)=0.001mol/(L·s)
C.υ(NO)=0.001mol/(L·s) D.υ(H2O)=0.045mol/(L·s)
13.按要求顺序填写序号:下列物质中,含离子键的是_____,由极性键形成的极性分子是_____,由极性键形成的非极性分子是______,由非极性键形成的非极性分子是____。①CO2 ②Br2 ③KF ④H2O
A.①②③④ B.②①④③ C.③①④② D.③④①②
14.往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
A.颜色变浅 B.变为绿色 C.没有改变 D.变棕黄色
15.可逆反应mA(g) ![]() nB(g)+ pC(s)+Q,温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是:
nB(g)+ pC(s)+Q,温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是:
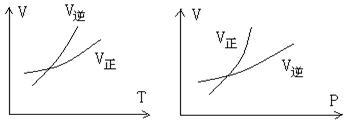
A.m>n,正反应放热
B.m>n+p,正反应放热
C.m>n,正反应吸热
D.m<n+p,正反应吸热、
16.工业上合成氨的反应为:N2(g)+3H2(g) ![]() 2NH3(g);(正反应为放热反应),则下列说法正确的是:
2NH3(g);(正反应为放热反应),则下列说法正确的是:
A.通常采用2×107Pa~5×107Pa的压强,是因为在该压强下铁触媒的活性最大
B.合成氨工业的反应温度控制在500℃,目的是使化学平衡向正反应方向移动
C.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高
D.为了增加NH3的产率、使平衡向正反应方向移动,工业上要使用催化剂
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、填空题:(共24分)
17.(4分)配平下列氧化还原反应方程式。
(1) ___S +___HNO3 ——___SO2 +___NO+ ___H2O
(2)___MnO4- +___NO2-+____H+ ——___Mn2+ +___NO3- +___H2O
18(4分) 牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH![]() 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
①进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是__________________________________________。
②根据以上原理,请你提出一种促进牙齿矿化的方法:__________________。
19.(9分)2Cl2(g)+2H2O(g)![]() 4HCl(g)+O2(g)(正反应为吸热反应),将Cl2、H2O、HCl、O2四种气体混合,反应达到平衡后,改变下列条件,把影响平衡的情况填在横线上。
4HCl(g)+O2(g)(正反应为吸热反应),将Cl2、H2O、HCl、O2四种气体混合,反应达到平衡后,改变下列条件,把影响平衡的情况填在横线上。
(1)加入O2后,HCl的物质的量______,平衡向________移动,Cl2的转化率____。
(2)升高温度,正反应速率______,逆反应速率______,平衡向________移动。
(3)加入催化剂,正反应速率_______,逆反应速率______,平衡______移动。
20.(7分)如下图所示,A→E五中含氮物质相互转化的关系图,其中,A、B、C、D在常温下都是气体,B为红棕色。写出各步反应的化学方程式。
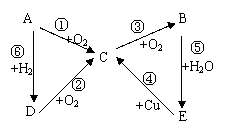 各步反应的化学方程式 :
各步反应的化学方程式 :
(1)写出下列物质的化学式:
A:_______ B:______ C:_________
(2)写出下列各步反应的化学方程式:
②________________________________________
④_________________________________________
三、实验题:(共20分)
21.(8分)用大试管收集NO2气体,倒扣在盛有水的水槽中,不久看到的现象是:________________________、________________________________;再向试管里通入氧气,又出现_____________________________________;试解释上述现象(用化学方程式表示)___________________、___________________________
22. (12分)氨(NH3)是重要的含氮化合物。1774年该气体由英国普里斯特里利用熟石灰和氯化铵加热反应制成。(1)写出实验室制取氨气的化学方程式 ;
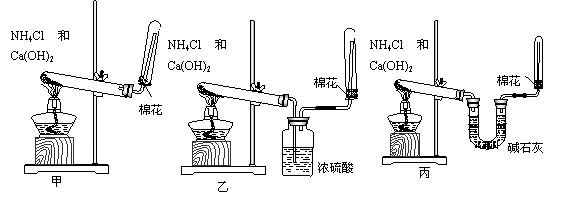 (2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
(2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ;
 (3)如何检验氨气是否收集满(简述操作方法、现象和结论)
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)
;
(4)该实验装置与实验室制备 气的装置相同.;
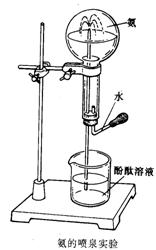
(5)如右图在圆底烧瓶里收集干燥的氨气。挤压胶头滴管中的少量水,使它射入烧瓶中,接着你会观察到的现象是 ,该现象说明氨气具有的性质是 , ;
(6)有同学用氨的喷泉实验装置做喷泉实验,但实验失败,请分析实验失败的可能原因 _。
(写出任何一个合理答案即可)。
四、计算题:(共8分)
23.(8分)实验室可用氯酸钾与浓盐酸反应制取氯气,该反应的化学方程式为:
KClO3+6HCl(浓)====KCl+3H2O+3Cl2↑
现将24.5g KClO3跟150mL 12mol/L盐酸充分反应,求:
⑴生成的Cl2在标准状况下体积为多少升?
⑵将反应后混合液稀释至500mL,此时溶液中Cl-的物质的量浓度为多少?
高二化学(理科)参考答案及评分标准
一、选择题(本大题包括16个小题,每小题3分,共48分。每小题只有一个正确答案。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | C | B | B | C | B | D | A | B | C | B | C | D | D | A | C |
二、填空题(共24分)
![]() 17.(4分)(1)3,4=3,4,2 (2)2,5,6=2,5,3 (每小题2分)
17.(4分)(1)3,4=3,4,2 (2)2,5,6=2,5,3 (每小题2分)
18.(4分)①食物发酵产生的有机酸中和OH-,使Ca5(PO4)3OH 5 Ca2++3PO43-+OH- 的平衡向右移动,导致牙齿受到腐蚀②使用含Ca2+或PO43-或OH-的牙膏(每空2分,共4分)
19.(9分)(1)减小,逆反应,减小 (2)增大,增大,正反应 (3)增大,增大,不(每空1分)
![]() 20.(7分)A:N2 B:NO2 C:NO (每空1分,共3分)
20.(7分)A:N2 B:NO2 C:NO (每空1分,共3分)
②4NH3+5O2 4NO+6H2O
④3Cu+8HNO3 △ 3Cu(NO3)2+2NO↑+4H2O (每个方程式2分,共4分)
三、实验题(每21小题8分,第22小题12分,共20分)
21.(8分)试管里红棕色气体消失;试管里水面上升到容积的大约2/3处(2分);气体先变为红棕色,接着红棕色气体又消失,液面上升(2分); 3NO2+H2O 2HNO3+NO;2NO+O2 2NO2。(4分)
22.(12分)(1)2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O;(2分,条件不写扣1分)
(2)丙;(2分)
(3)将蒸馏水湿润的红色石蕊试纸放在试管口,若试纸变蓝说明NH3已收满;(2分)
(4)氧气;(1分)
(5)红色溶液喷入圆底烧瓶(1分),NH3易溶于水(1分),NH3与水反应生成碱(1分);
(6)装置气密性差、烧瓶不干燥、选用试剂不当等(答对任何一项即可)(2分)
四、计算题(共8分)
23.(8分)解:设生成Cl2在标况下体积为X
KClO3 + 6HCl(浓) KCl+3Cl2↑+3H2O……(1分)
1 6 22.4L/mol×3
![]() =0.2mol 0.15L×12mol/L=1.8mol X ……(2分)
=0.2mol 0.15L×12mol/L=1.8mol X ……(2分)
根据方程式判断:浓HCl过量 ……(1分)
X=0.2mol×22.4L/mol×3=13.44L ……(1分)
浓HCl过量:1.8mol-0.2mol×6=0.6mol
新生成KCl:0.2mol ……(1分)
![]() =
=![]() =1.6mol/L
……(2分)
=1.6mol/L
……(2分)
答:略