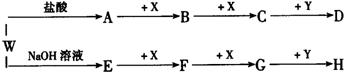高二化学第一学期期中形成性试卷
高二化学(理科重点)
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Cu~64
一、选择题(本大题包括16小题,每小题3分,共48分)每小题只有一个选项符合题意,请将正确选
项的序号填入第一大题后答题表的相应空格内。
1.砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用—定剂量的氧化剂解毒。下列有关叙述正确的是
A.砷元素在化合物中的常见价态有+3、+5、+7
B.砷酸的酸性强于磷酸
C.砷化氢(AsH3)比NH3稳定
D.砷的+3价化合物的毒性强于+5价化合物
2.下列各组物质中,都是由极性键构成的极性分子是
A.CH4和Br2 B.NH3和H2O
C.H2O和CCl4 D.CO2和HCl
3.反应4NH3(g)+5O2(g)≒4NO(g)+6H2O(g),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() (x)可表示为
(x)可表示为
A.![]() ( NH3)=0.010mol/(L·s)
B.
( NH3)=0.010mol/(L·s)
B.![]() (O2)=0.0010mol/(L·s)
(O2)=0.0010mol/(L·s)
C.![]() (NO)=0.0010mol/(L·s)
D.
(NO)=0.0010mol/(L·s)
D.![]() ( H2O)=0.045mol/(L·s)
( H2O)=0.045mol/(L·s)
4.长期放置的浓硝酸常显黄色,消除其中的黄色最好的方法是
A.在光照处放置 B.通入适量的空气
C.加入足量水 D.加入漂白粉
5.0.3molCu2S与足量的浓HNO3反应,生成Cu(NO3)2、H2SO4、NO2、H2O,则参加反应的硝酸中,未被还原的硝酸的物质的量是
A.0.6mol B.1.0mol C.1.2mol D.2.2mol
6.现有下列各组溶液:①10℃时10mL 0.1mol/L的Na2S2O3溶液和10mL0.1mol/L的H2SO4溶液;②10℃时10mL 0.05mol/L的Na2S2O3溶液和l0mL 0.1mol/L的H2SO4溶液;③30℃时10mL 0.1mol/L的Na2S2O3溶液和10mL0.1mol/L的H2SO4溶液。若同时将它们混合发生反应:Na2S2O3+ H2SO4≒Na2SO4+S↓++SO2↓+H2O,则出现浑浊的先后次序是
A.①②③ B.②①③ C.①③② D.③①②
7.反应NH4HS(s)≒NH3(g)+H2S(g) 在某温度下达到平衡,下列各种情况下,不能使平衡发生移动的是
①其它条件不变时,通入SO2 ②移走一部分NH4HS固体
③容器体积不变,充人氮气 ④保持容器压强不变,充人氮气
A.①② B.①④ C.②③ D.②④
8.在密闭容器中进行如下反应:X2(g)+Y2(g)≒2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
①Z为0.3 mol/L ②Y2为0.35 mol/L ③X2为0.2 mol/L ④Z为0.4 mol/L
A.①② B.①③ C.②④ D.③④
9.以下贮存物质的方法正确的是
A.少量白磷贮存在二硫化碳中
B.水玻璃贮存在带玻璃塞的玻璃瓶中
C.少量碘贮存在酒精中
D.浓硝酸贮存在棕色的玻璃瓶中
10.一定温度下,在一个容积固定不变的密闭容器中进行X(g)+3Y(g)≒4Z(g)+W(s)反应,达到平衡状态的标志是
①气体的密度不再变化 ②气体的压强不再变化 ③单位时间内生成amolX,同时生成3amolY
④单位时间内生成3amolY,同时生成4amolZ
A.①④ B.②③ C.③④ D.①③
11.在常温下,在下列溶液中加入足量的铁,充分反应后,生成H2量最多的是
A.80mL2mol/L的硫酸
B.40mLl4mol/L的硝酸
C.20mL12mol/L的盐酸
D.10mLl8mol/L的硫酸
12.在一固定容积的密闭容器中加入2molA和lmolB发生下列反应并且达到化学平衡状态,
2A(g)+B(g)≒3C(g)+D(g)。平衡时C的浓度为a mol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为a mol/L的是
A.4molA+2mol B B.2molA+lmol B+3mol C+lmol D
C.3mol C+lmol D D.3mol C+lmol D+lmol B+lmol A
13.下列离子方程式书写正确的是
A.氯化铵溶液与氢氧化钠稀溶液混合:NH4++OH—=NH3↑+H2O
B.稀HNO3和Cu反应:Cu+4H++NO3—=Cu2++NO2↑+2H2O
C.硝酸和氧化铜反应:2H++2NO3—+CuO=Cu(NO3)2+H2O
D.氨气与盐酸反应:NH3+H+=NH4+
|
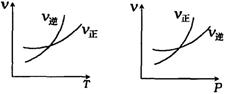
A.m>n,正反应放热
B.m>n+p,正反应放热
C.m>n,正反应吸热
D.m<n+p,正反应吸热
15.为了除去铝表面的铜镀层可选用的试剂是
A.稀HNO3 B.浓HNO3 C.浓H2SO4 D.浓盐酸
16.—个真空密闭容器中盛有lmolPCl5,加热到加200℃时发生了反应PCl5(g)≒PCl3(g)+Cl2(g),反应达到平衡后PCl5的转化率为M%,若在同一温度下和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的转化率为N%,M与N的关系正确的是
A.M>N B.M<N C.M=N D.不能确定
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(本大题包括4小题,共23分)
|
(1)磷在空气中与O2作用生成A的化学方程式为____________________________________;
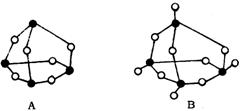
(2)A在空气中受热可转化为B,B的立体结构如图B,它的化学式为_____________;
写出B与热水反应的化学方程式______________________________________;
(3)写出A与HCl气体反应生成能在空气中形成白雾的气体的化学方程式
__________________________________________。
18.(3分)近些年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式:NH3+HClO≒H2O+NH2Cl(一氯氨),NH2C1较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因_________________________________________________________________________________
___________________________________________________________________________________
___________________________________________________________________________________。
19.(6分)在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3+Q。已知常压下平衡混合气体SO3体积分数为91%,试回答:
(1)在生产中常用过量的空气是为了____________________________________________________
________________________________________________________________________________;
(2)加热到400℃—500℃是由于________________________________________________________
_________________________________________________________________________________;
(3)压强采用______________;原因是___________________________________________________
_________________________________________________________________________________;
(4)尾气中的SO2必须回收,原因是____________________________________________________
________________________________________________________________________________。
20.(7分)按下图所示W是—种正盐,X、A、E都是常见气体,同温同压下A、E的密度比为2:1,
|
(1) W、X、D的化学式分别是____________、_____________、___________;
(2)W与NaOH溶液反应的离子方程式为:_________________________________;
(3)A与H稀溶液反应能生成淡黄色沉淀,此反应的化学方程式为
_____________________________________________。
三、实验题(本大题包括2小题,共19分)
|
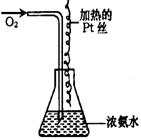
(1)实验开始一段时间后,可观察到锥形瓶口上方有白烟生成,
请将可能观察到的其他现象补齐:____________________
________________________________;有关化学方程式为
__________________________________________________
__________________________________________________
__________________________________________________;
(2)由于气温的原因,上述实验一段时间后现象不太明显,需
向锥形瓶内加入下列哪种物质才能看到明显的现象
(填代号)_______________;
A.NaOH固体 B.生石灰 C.浓H2SO4 D.NH4C1固体
(3)经过对比试验证明,在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是
___________________________________________________________________________
___________________________________________________________________________。
|
(1)用此仪器不能反复进行的实验是____________(填写编号)
A.NH4CI固体受热分解 B.KMnO4晶体受热分解
C.白磷和红磷互相转化 D.无水CuSO4和胆矾的互变实验
(2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验。该实验的操作过程和实验现象是____________________________________________________
________________________________________________________________________________
________________________________________________________________________________;
(3)如果玻璃管内装有某红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是____
__________________________;如果玻璃管内装有无色溶液,加热时溶液变缸,冷却后恢复无色,此溶液可能是____________________________________________。
四、计算题(本大题包括2小题,共10分)
23.(4分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为___________L,NO:的体积为___________L;
(2)待产生的气体全部释放后,向溶液中加入VmLamol / L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_______mol / L。
24.(6分)在标准状况下,有1molA气体发生如下反应:2A(g)≒B(g)+xC(g);在一定条件下反应达到平衡。在平衡混合气中,A的体积百分含量为58.6%,混合气的总质量为46g,密度为1.776g/L。求:
(1)达到平衡后混合气体的平均相对分子质量;
(2)达到平衡后A的转化率;
(3)C物质的系数x的数值。
参考答案: