高二化学第一学期期中测试卷
试题
(时间:90分钟 满分100分)
2006年11月
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。
第Ⅰ卷(选择题,共51分)
注意事项:
1、答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目填写在答题卡上。
2、每小题选出答案后,有铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试题卷上。
3、相对原子质量:H:1 O:16 Na:23 Mg:24 C1:35.5
一、选择题(本大题共17个小题,每小题3分,共51分。每小题四个选项中,只有一项符合题目要求,请将符合题目要求的选项选出)
1、当前我国环保亟待解决的“白色污染”,通常所指的是( )
A、 冶炼厂的白色烟尘 B、石灰窑的白色粉尘
C、聚乙烯等塑料垃圾 D、白色建筑废料
2、下列有关有机物的说法中正确的是( )
A.凡是含碳元素的化合物都属于有机物;
B.易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物;
C.所有的有机物都很容易燃烧;
D.大多数有机物的熔沸点比较低
3、丙烯酸的结构简式为CH2=CH—COOH,对其性质的描述不正确的是( )
A 能与金属钠反应放出氢气
B 不能与新制氢氧化铜悬浊液反应
C 能发生加聚反应生成高分子化合物
D 能与溴水发生加成反应而使溴水褪色
4、1克氢气燃烧生成液态水放出142.9 kJ热,表示该反应的热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ
C.2H2 + O2 = 2H2O; △H =-571.6 kJ
D.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8k
5、某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为 ( )
A、铝 B、铜 C 、锡 D 、硅
6、下列关于电解槽叙述中不正确的是 ( )
A.电子从电源的负极沿导线流入电解槽的阴极
B.与电源负极相连的是电解槽的阴极
C.与电源正极相连的是电解槽的阴极
D.在电解槽的阳极发生氧化反应
7、理论上不能设计为原电池的化学反应是
A.CH![]() (g)+2O
(g)+2O![]() (g)
(g)![]() CO
CO![]() (g)+2H
(g)+2H![]() O(1);△H<0
O(1);△H<0
B.HNO![]() (1)+NaOH(1)
(1)+NaOH(1)![]() NaNO
NaNO![]() (1)+H
(1)+H![]() O(1);△H<0
O(1);△H<0
C.2H![]() (g)+O
(g)+O![]() (g)
(g)![]() 2H
2H![]() O(1);△H<0
O(1);△H<0
D.2FeCl![]() (1)+Fe(s)
(1)+Fe(s)![]() 3FeCl
3FeCl![]() (1);△H<0
(1);△H<0
8、将分别盛有熔融的KCl、MgCl2 和氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
9、有关加聚反应和缩聚反应的叙述中正确的是 ( )
A.加聚反应合成的高分子化合物的平均相对分子质量比缩聚反应的产物的平均相对分子质量小
B.加聚反应和缩聚反应可以由相同或不相同单体之间发生反应
C.加聚反应只能得到塑料,缩聚反应可得到合成纤维和合成橡胶

10、关于吸热反应的说法,正确的是
A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应
C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应
11、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: 负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.025摩,这时电池内消耗的H2 SO4的物质的量至少是 ( )
A、0.025摩 B、0.050摩 C、0.10摩 D、0.20摩
12、某原电池总反应的离子方程式: 2Fe3+ + Fe=3Fe2+不能实现该原理反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe, 负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
13、取a g 某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加a g ,下列物质中不能满足上述结果的是 ( )
A CH2O B CO C C6H12O6 D C6H6
14、某气态烃10mL与50mL氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气40ml,一氧化碳和二氧化碳各20mL,(各气体体积均在同温同压下测定),该烃的分子式为 ( )
A.C3H8 B.C4H8 C.C3H6 D.C4H6
15、下列关于铜电极的叙述正确的是 ( )
A. 在镀件上电镀铜时可用金属铜作阳极
B.用电解法精炼粗铜时粗铜作阴极
C.铜锌原电池中铜是负极
D.电解稀硫酸制H2、O2时铜作阳极
16、 X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y;X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子。则这四种金属的活动性由强到弱的顺序为 ( )
A. X>Z>Y>M B.X>Z>M>Y C.M>Z>X>Y D. X>M>Z>Y
17、某药物结构简式为:
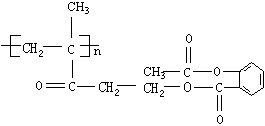 |
该物质1mol与足量的NaOH 溶液反应,消耗NaOH的物质的量为( )。
A.3mol B.4mol C.3n mol D.4n mol
第II卷(非选择题,共49分)
注意事项:
1、答卷前将密封线内的项目填写清楚。
2、用钢笔或圆珠笔答在答题页上,只交答题页与答题卡。
二、填空:
18、(1).由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+1/2O2(g)==H2O(l)的
△H=___________kJ·mol-1。氢气的燃烧热为__________kJ·mol-1。
(2) 0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式是__________________。
又知:H2O(l)==H2O(g);△H= +44kJ·mol-1,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_______________kJ。
19、金属的电化学腐蚀分为 和 。钢铁发生吸氧腐蚀时,正极发生 反应,负极发生的电极反应式为
20、如图所示,组成一个原电池.
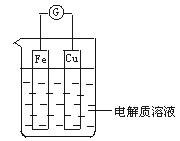
(1)当电解质溶液为稀硫酸时:
①Fe电极是__________(填“正”或“负”)极,其电极反应为___________________,该反应是__________(填“氧化”或“还原”)反应;
②Cu电极是__________电极,其电极反应为______________________,该反应是__________反应.
21、某烃的相对分子质量为114,该烃的分子式为__________;它的主链碳原子数最少且其一氯代物只有一种的烃的结构简式为____________;其一种同分异构体对应的单烯烃只有两种,则这种同分异构体的结构简式为_____________;对应的两种烯烃名称为________和________ 。
22、电解精炼铜时以含有少量锌、银、金、镍(Ni)等杂质的粗铜作为阳极,以纯铜片作为阴极,以CuSO4溶液为电解液,进行电解。回答下列问题:
(1)阴极发生反应的电极方程式为:______;阳极发生反应的电极方程式为:______。
(2)通电一段时间后切断电源,测得阴极增重3.2kg,则导线上通过的电子物质的量为______mol
三、实验题:(10分)
23、50ml0.50mol/l盐酸与50ml0.55mol/l NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
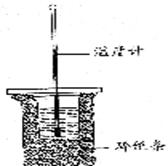
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(4)若上述HCl和NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J·(g-1·0C-1),实验起始温度为t1℃,终止温度为t2℃,则该中和反应放出热量为
KJ/mol,![]() KJ/mol(均填表达式)。
KJ/mol(均填表达式)。
(5)该实验常用0.50mol/lHCl 和0.55mol/l的NaOH溶液各50ml。NaOH的浓度大于HCl的浓度的作用是 。当室温低于100C时进行,对实验结果会造成较大的误差其原因是 。
(6)实验中改用60ml0.50mol/l盐酸与50ml0.55mol/l NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(7)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”“偏小”或“无影响”)。
四、推断题:(8分)
24、烷烃A只可能有三种一氯取代产物B、C和D。C的结构简式是
(CH3)2 C CH2CI
![]()
CH2CH3
B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
E
![]() ①
①
NaOH,醇 Δ NaOH 氧化 [Ag(NH3)2]+OH -
![]()
![]()
![]()
![]()
![]() B ②
F③
G
H
B ②
F③
G
H
一氯取代 H2O H2O ,H+
![]() A
C
A
C
![]() D
D
![]() NaOH,醇 Δ
NaOH,醇 Δ
E (物质转化关系)
请回答:(1)A的结构简式是 __________________________。
(2)E的结构简式是 。
![]() (3)写出下列反应的化学方程式和反应类型:
(3)写出下列反应的化学方程式和反应类型:
反应①_____________________( )
反应③_____________________( )
五、计算题:(8分)
25、某有机化合物与金属钠反应放出氢气,充分燃烧4.44克该有机物,将燃烧后的气体通入浓硫酸质量增加5.4克;将剩余的气体通过NaOH溶液,溶液质量增加10.56克。由质谱得出此种有机化合物的相对分子质量为74。试推断该有机物的分子式,并写出其可能的结构简式。
高二化学期中测试答题页
18、(1)_________________________________, ___________,__________
(2)__________________________________,_____________
19、____________ _____________ ________ _____________________
20、①_____ _____________________________ ___________
②______ _____________________________ ____________
21、____________ ________________________ _______________________
____________________ ____________________
22、(1)____________ (2)__________________________________
(3)________ (4)_________________ ________________
(5)____________________ ______________________
(6)_____ ______________________________________________________
______________________________(7)____________
23、(1)_________________________ (2)________________________
(3)____________________________________________ ( )
(4)_____________________________________________ ( )
24、解:
答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | D | B | B | C | C | B | D | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| D | B | C | D | B | A | A | C |
二、18、(1)H2(g)+![]() O2(g)==H2O(g);△H=-241.8kJ/mol; -285.8; 285.8
O2(g)==H2O(g);△H=-241.8kJ/mol; -285.8; 285.8
(2)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ/mol; 1016.5
19、析氢腐蚀、吸氧腐蚀;还原 ,Fe-2e-=Fe2+
20、①负 Fe-2e-=Fe2+ 氧化 ②正 2H++2e-=H2↑ 还原
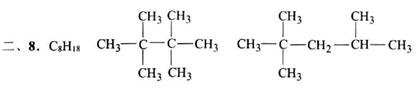
2,4,4-三甲基-1-戊烯 2,4,4-三甲基-2-戊烯
22、(1)Cu2++2e=Cu;Cu-2e=Cu2+ Ni-2e=Ni2+ Zn-2e=Zn2+ (2)100
三、23、(1)环形玻璃搅拌棒
(2)保温隔热,减少实验中的热量损失
(3)偏小
(4)0.209(t2-t1);-0.209(t2-t1)
(5)保证盐酸完全反应;内外温差大,损失热量
(6)相等;因为中和热是指稀溶液中酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关。
(7)偏小
四、24、(1) (CH3)3CCH2CH3 (2) (CH3)3CCH=CH2
NaOH,醇
![]() (3)(CH3)3CCH2CH2Cl
(CH3)3CCH=CH2 + HCl 消去反应
(3)(CH3)3CCH2CH2Cl
(CH3)3CCH=CH2 + HCl 消去反应
Δ
Cu
![]() 2(CH3)3CCH2CH2OH + O2
2(CH3)3CCH2CHO +H2O 氧化反应
2(CH3)3CCH2CH2OH + O2
2(CH3)3CCH2CHO +H2O 氧化反应
Δ
五、25、解:C4H10O