高二化学第一学期期中考试
化学选修测试题
说明:本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1~4页,第Ⅱ卷5~8页,共150分,考试时间为120分钟。
可能用到的相对原子质量:
C-12 H-1 O-16 N-14 S-32 Cl-35.5 Li-7 Na-23 K-39 Cu-64 Fe-56
第Ⅰ卷 选择题(共70分)
一.单项选择题(本题包括15小题,每小题2分,共30分。每小题只有一个正确选项)
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是 B
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.此项工作可以用来改变分子的某些物理性质
D.此工作可广泛应用于光电器件、生物技术等方面
2.下列物质按纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是B
A.纯盐酸、水煤气、硫酸、醋酸、干冰
B.冰醋酸、玻璃、硫酸钡、氢氟酸、乙醇
C.单甘油酯、冰水混合物、苛性钠、氢硫酸、三氧化硫
D.绿矾、漂白粉、次氯酸、氯化钾、氯气
3.在无土栽培中需用浓度为0.5mol/LNH4Cl、0.16mol/LKCl、0.24mol/LK2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是 D
A.0.4mol、0.5mol、0.12mol B.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24mol D.0.64mol、0.02mol、0.24mol
4.下列说法不正确的是 D
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
C.在101KPa ,1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
D.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
5.下列事实不能用勒夏特列原理解释的是 B
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.温度过高对合成氨不利
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
6.勤洗手和经常对环境进行消毒是预防传染病的有效途径。某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。则该消毒液的主要成分可能是 C
A.KMnO4 B.H2O2 C.NaClO D.NH3·H2O
7.碘化砹(AtI)可发生下列反应,①2AtI+2Mg==MgI2+MgAt2 ②AtI+2NH3(l)==NH4I+ AtNH2。对上述两个反应的有关说法正确的是 B
A.这两个反应都是氧化还原反应
B.反应①MgAt2既是氧化产物,又是还原产物
C.反应②中AtI既是氧化剂,又是还原剂
D.MgAt2的还原性弱于MgI2的还原性
8.强酸和强碱稀溶液的中和热表示为 H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l); △H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l); △H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l); △H=-c kJ·mol-1
则a、b、c三者的大小关系为 B
A.a>b>c B.b>c>a C.a=b=c D.无法比较
9.已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO![]() 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 D
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 D
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
10.(NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入足量的BaCl2溶液,产生的沉淀为 A
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
11.下列实验操作中错误的是: C
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,温度计的水银球应靠近蒸烧瓶的支管口
C.中和滴定时,左手控制活塞,右手握持锥形瓶,眼睛注视滴定管中液面的变化
D.用托盘天平称量物体的质量时,物体放在左盘,砝码放在右盘
12.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:
A(固)+2B(气)![]() C(气)+D(气)已达平衡的是 A
C(气)+D(气)已达平衡的是 A
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均分子量
13.常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是 D
A.4 B.4.6 C.5.4 D.6
14.反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是 A
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
15.某恒温恒容的容器中,建立如下平衡:2NO2(g)![]() N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时 A
N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时 A
A.都增大 B.都减小 C.前者增大后者减小 D.前者减小后者增大
二. 不定项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若该题只有一个正确选项,多选时该题为0分,只有答对才给4分;若该题有两个正确选项,只选一个且正确时给2分,选两个且都正确时给4分。)
16.常温,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH—)=10—24,则下列各组离子在该溶液中一定可以大量共存的是 D
A.K+、Na+、AlO2—、Cl— B.Na+、Cl—、SO42—、HCO3—
C.NH4+、Na+、NO3—、SO42— D.Ba2+、Na+、Cl—、NO3—
17.化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是
A.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7 : BD
SO42- + 2H+ + Ba2+ + 2OH- = BaSO4↓ + 2H2O
B.明矾水解的离子方程式: Al3++3 H2O===Al(OH)3 ↓+3H+
C.Mg(HCO3)2 溶液与盐酸溶液反应的离子方程式:HCO3-+ H+ == CO2↑+H2O
D.常温常压下,1g氢气充分燃烧生成液态水,放出142.9 kJ热量。则表示氢气燃烧的热化学方程式: 2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ·mol-1
18. Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ + 2H2O ![]() Fe(OH)2 + 2H+ ,往该溶液中逐滴加入盐酸,发生的变化是 BC
Fe(OH)2 + 2H+ ,往该溶液中逐滴加入盐酸,发生的变化是 BC
A.平衡向正反应方向移动 B.平衡和逆反应方向移动
C.溶液颜色由浅绿色变为棕黄色 D.溶液由浅绿色变为灰绿色
19.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7。下表中判断合理的是 BD
| 编号 | HX | YOH | 溶液的体积关系 |
| A | 强酸 | 强碱 | V(HX)=V(YOH) |
| B | 强酸 | 强碱 | V(HX)>V(YOH) |
| C | 强酸 | 弱碱 | V(HX)=V(YOH) |
| D | 弱酸 | 强碱 | V(HX)<V(YOH) |
20.在一定温度下,向饱和烧碱溶液中放入一定量的Na2O2,完全反应恢复到原温度,下列说法正确的是 CD
A.溶液中c(Na+)增大,有O2放出。 B.溶液pH值不变,有H2放出。
C.溶液中Na+数目减少,有O2放出。 D.溶液中pH值不变,有O2放出。
21. 把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s)![]() Ca2+ (aq)+2OH-(aq)。下列说法正确的是 BC
Ca2+ (aq)+2OH-(aq)。下列说法正确的是 BC
A.加热,溶液的pH升高 B.恒温下,加入CaO,溶液pH不变
 C.加入CaCl2晶体,Ca(OH)2 固体增多 D.加入Na2CO3晶体,固体质量减少
C.加入CaCl2晶体,Ca(OH)2 固体增多 D.加入Na2CO3晶体,固体质量减少
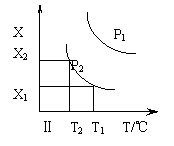
22.右图表示温度和压强对可逆反应:
2K(g)+Q(g)![]() 2Y(g) ;△H<0的影响。
2Y(g) ;△H<0的影响。
下列有关说法可能正确的是 A
A.x轴表示Y的体积分数
B.x轴表示气体混合物的质量
C.其他条件相同时,P2下先达到化学平衡状态
D.P1<P2
23.甲酸的下列性质中,不可以证明它是弱电解质的是 B
A.1 mol·L-1甲酸溶液的pH值约为2
B.甲酸能与水以任何比例互溶
C.10mL1 mol·L-1甲酸与10 mL1 mol·L-1NaOH溶液完全反应后,溶液呈碱性
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱
24.取pH值均等于2的盐酸和醒酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是 B
A.醋酸与锌反应放出H2多B.盐酸和醋酸分别与锌反应放出的H2一样多
C.醋酸与锌反应速率小 D.盐酸和醋分别与锌反应的速度一样大
25.下列说法正确的是 AC
A.常温下醋酸分子可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:
c(Cl-) >c(NH4 +)
C.0.1mol·L-的氯化铵溶液与0.05mol·L-的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)
D.0.1mol·L-1硫化钠溶液中离子浓度关系: c(Na+)=c(S2-)+c(HS-)+c(H2S)
化学选修测试题
班别: 姓名: 学号: 得分:
第Ⅱ卷 非选择题(共80分)
三.实验题(共17分)
26.(10分)
(1)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):
②容量瓶:
③滴定管:
④集气瓶(收集氨气):

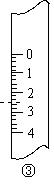
 ⑤托盘天平
⑤托盘天平
(2)右图分别是温度计、量筒、滴定管的一部分,则:
量筒应该是 ②, 读数为 mL
滴定管应该是 ,读数为 mL
温度计应该是 ,读数是 ℃
27.(7分)含有酚酞的氢氧化钠的溶液中,逐滴滴加新制氯水,边滴边振荡,直到红色褪去。请分析回答下列问题:
① 氯水中存在分子有:_______________和离子有:________________________。
② 氢氧化钠酚酞溶液褪色的原因可能是:
a._____________________________;b.__________________________ 。
③ 如何用实验证明你对褪色的原因的推测呢?简要叙述你的实验设计思路。
_________ _______
_________ _______ _________ _______ _______ _______ 。
四.填空题(共24分)
28.(12分)
(1)工业上从海水中提取金属镁的反应如下:
Ca(OH)2+Mg2+ (海水中)=Mg(OH)2↓+Ca2+
Mg(OH)2+2HCl=MgCl2+H2O
MgCl2 ![]() Mg+Cl2↑
Mg+Cl2↑
在提取过程中,当氯化镁从溶液中析出时,得到的是MgCl2·6H2O。为制得无水氯化镁,工业上常将MgCl2·6H2O在HCl气氛中加热来制取。试解释其原因(用文字简要回答)
_____________________________________________________________________
_________________________________________________________________________________________________________________________________________。
(2).已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2(氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。 试回答:
①混合加热时发生反应的化学方程式是__________________________________;
②SOCl2的作用是_____________________________________________________。
(3)在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。 甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 ![]() Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案说明问题:
_____________________________________________________________________
_________________________________________________________________________________________________________________________________________。
29.(7分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
30.(10分)
(1) (3分) 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
(2) (3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
(3) (4分)有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
| Na2S2O3·5H2O | CaCl2·6H2O | Na2SO4·10H2O | Na2HPO4·12H2O | |
| 熔点(℃) | 40.50 | 29.92 | 32.38 | 35.1 |
| 熔化热(kJ/mol) | 49.7 | 37.3 | 77 | 100.1 |
①上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
; 。
② 实际应用时最常采用的(由来源和成本考虑)应该是 。
31.(10分)
(1)(2分)有五瓶溶液分别是①10毫升0.60摩/升NaOH水溶液 ②20毫升0.50摩/升硫酸水溶液 ③30毫升0.40摩/升HCl溶液 ④40毫升0.30摩/升CH3COOH水溶液 ⑤50毫升0.20摩/升蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________________________________。
(2)(8分)25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=________________________(填数据);
②若x+y=13,则a/b=________________________(填数据);
③若x+y>14,则a/b=________________________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH、x和y的关系式:
_________________________________________(填表达式)。
 32.(10分)在一定条件下,二氧化碳和氧气发生如下反应:
32.(10分)在一定条件下,二氧化碳和氧气发生如下反应:
2SO2(g)+ O2 (g) ![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化碳转化率 ,化学反应速度 (以上均填“增大、减小或不变”)
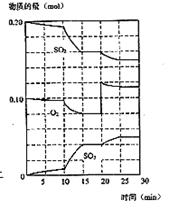
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
33.(8分)现有浓度为0.1 mol·L-1的五种电解质溶液:
①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,
已知:CO2+3H2O+2AlO2-![]() 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是____________________(填编号,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是__________;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是____;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式______________________________________。
34.(6分)某温度下SO2的转化反应的平衡常数K =532.4,2SO2+O2 ![]() 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.0862 | 0.263 | 1.020 |
试判断各体系中反应进行的方向:
体系(1)
体系(2)
体系(3) 。
化学选修测试题(2006-11-08)参考作案
26.(1)①把试纸用蒸馏水湿润 ② 检查容量瓶是否漏水
③用待装液润洗滴定管2-3次(也可以写:检查滴定管是否漏水)
④干燥集气瓶 ⑤ 调节零点
(2)③,2.4 ①,2.5
27.分子: 离子:
因为HCl和HClO的酸性所致;因为HClO的强氧化性所致
向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色重现,则是因为HCl和HClO的酸性所致;若红色不再重现,则是因为HClO的强氧化性所致。
28.(1)因为Mg2+能水解显弱酸性,加热时促进水解反应的进行, 生成更多的Mg(OH)2,而且加热蒸干时,Mg(OH)2还会分为MgO,从而得不到无水MgCl2,将MgCl2·6H2O;在HCl气氛中加热,可抑制水解,防止副反应发生而得到无水氯化镁。
(2)(1) ZnCl2·xH2O+xSOCl2=ZnCl2+xSO2+2xHCl
(2) 夺去ZnCl2·xH 2O中的水,同时生成HCl,它可以抑制ZnCl2的水解。
(3)
29.(1)N2H4(l)+2H2O2(l) == N2(g) +4H2O(g) △H=-644.25 KJ/mol
(2)410.125
(3)2产物不会造成环境污染。
30.(1)②③④
(2)CO(g)+FeO(s) == Fe(s)+CO2(g) △H=―218.0kJ/mol
(3)Na2SO4·10H2O Na2HPO4·12H2O ; Na2SO4·10H2O
31.(1)⑤④③②①;(2)1:1;1:10;10x+y-14; 无作案:
32.
33.(1)④②①③⑤ (2分) (2)⑤ (2分) (3)①② (2分)
(4)HCO3-+AlO2-+H2O![]() Al(OH)3↓+CO32- (2分)
Al(OH)3↓+CO32- (2分)
34.(1)逆方向进行 (2)正方向进行 (3)反应已达平衡状态