高二化学物质结构及元素周期律测试题
班级 姓名 学号
一.选择题(共60分,每小题只有一个选项)
1.据《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
2.下列各组物质中,互为同位素的是
A.重氢、超重氢 B.氧、臭氧 C.红磷、白磷 D.乙酸、丙酸
3. M 2+离子有2个电子层,则M在周期表的位置是
A.第二周期零族 B.第二周期Ⅷ族
C.第二周期ⅦA族 D.第三周期ⅡA族
4. 下列化学用语中,正确的是:
![]()
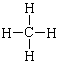
A. 甲烷的结构式: B. 镁的原子结构示意图:
![]() C. 氯化钠的电子式: D.
乙炔的分子式:C2H4
C. 氯化钠的电子式: D.
乙炔的分子式:C2H4
5. 下面互为同素异行体的一组是:
A. 红磷和白磷
B. 甲烷和乙烷 C.![]() 和
和![]() D. K和K+
D. K和K+
6. 在相同条件下,下列气态氢化物的稳定性排列顺序正确的是:
A. HI>HBr>HCl>HF B. HCl>HBr>HI>HF
C. HBr>HI>HF>HCl D. HF>HCl>HBr>HI
7.下列物质中,属于纯净物的是
A.氨水 B.聚乙烯 C.冰醋酸 D.汽油
8.某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的化学式为
A.HX B.H2X C.XH3 D.XH4
9.下列物质中,既有离子键又有共价键的是
A.H2O B.CaCl2 C.KOH D.C12
10.下列各组性质的比较中,不正确的是
A.碱性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3
C.金属性:K>Na D.原子半径:Cl>S
11.元素R的阴离子Rn-核外有x个电子,其核内的中子数为m,则R的质量数是
A.x-n B.m-x+n
C.m+x-n D.x+n
12.原子核内的质子数决定了
A.原子种类 B.元素种类
C.相对原子质量 D.质量数
13.某元素负一价阴离子的核外有10个电子,该元素在周期表中的位置是
A.二周期IA族 B.三周期ⅦA族 C.二周期ⅦA族 D.三周期IA族
14.下列各组的两种元素,能形成离子化合物的是
A、Mg、Cl B、Si、O C、Al、He D、H、C
15.下列微粒中,比镁原子少2个质子和2个电子的是
A、NH3 B、NH4+ C、H3O+ D、OH-
16.下列分子的结构为三角锥行的是
A、NH3 B、O3 C、H2O D、CH4
17.某元素原子核外M电子层的电子数与K层电子数相差5,则此元素在周期表中位于
A、第三周期第ⅤA族 B、第二周期第ⅤA族
C、第三周期第ⅦA族 D、第二周期第ⅦA族
18. 属于共价化合物的是
A. KCl B. H2SO4 C. Cl2 D. Mg(NO3)2
19. 下列晶体属于原子晶体的是
A. 氯化钠 B. 干冰 C. 氧化铝 D. 二氧化硅
20. 下列性质的比较,错误的是
A. 稳定性 HI < HBr < HCl < HF
B. 酸性 H2SiO3 < H3PO4 < H2SO4 < HClO4
C. 原子半径 O < F < Na < Mg
D. 氧化性 K+ < Fe2+ < Cu2+ < Ag+
21. 某元素的一价阴离子,核外有10个电子,质量数为19,则中子数为
A. 9 B. 10 C. 11 D. 12
22.组成下列物质的所有原子的最外层均满足8个电子的一组是
A.H2O B.BF3 C.PCl5 D.CO2
23.下列微粒性质的比较中正确的是
A. B. C. D.
24.下列各组性质的比较中,不正确的是
A.碱性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3
C.金属性:K>Na D.原子半径:Cl>S
25.下列元素中,非金属性最强的是
A.硅 B.磷 C.硫 D.氯
26.下列物质中,只有共价键的是
A.NaCl B.HCl C.NaOH D.KCl
27.位于元素周期表第二周期第V A族的元素是
A.N B.F C.Mg D.P
28.下列原子结构示意图的书写,正确的是

29.下列叙述正确的是
A.离子化合物中不可能有非极性键
B.共价化合物分子里一定不含离子键
C.非极性键只存于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
30.下列离子中,电子数大于质子数且质子数大于中子数的是( )
A、D3O+ B、Li+ C、OD¯ D、OH¯
31.11H、21H、31H、H+、H2是
A.氢的五种同位素 B.五种氢元素
C.氢的五种同素异形体 D.氢元素的五种不同微粒
32.a、b、c为短周期元素,a元素的阳离子、b元素的阳离子、c元素的阴离子具有相同的电子层结构,a的原子半径大于b的原子半径,则a、b、c的原子序数大小为
A.a>b>c B.b>a>c C.a>c>b D.c>a>b
二、填空题 (每空1分,共40分)
33..A元素的原子核外K层和L层电子总数等于M层和L层电子总数,B元素和A元素可形成AB2型离子化合物,且B离子与Ar具有相同的电子层结构,则:
(1)A元素的名称___镁____;B的原子结构示意图是___________;
(2)在AB2中,A与B以___________键相结合,用电子式表示AB2的形成过程:
______________________________________.
| A | B |
| C |
34.如右图所示为A、B、C三种元素在周期表中的相对位置,已知A、B、C均为短周期元素,且三种元素的原子序数之和为31,最外层电子数之和为17。
⑴三种元素符号分别是A ;B ;C 。
⑵A的最高价氧化物对应水化物的分子式是 。
⑶B的氢化物的电子式是 。⑷C的阴离子结构示意图为 。
⑸C的最高价氧化物对应水化物的酸性比高氯酸 (填写“强”或“弱” )。
35..X、Y、Z为三种短周期元素,Y原子的最外层电子数是次外层电子数的3倍。X2+离子的电子层结构与氖原子相同。Y和Z属于同周期,1 mol Y单质与1 mol Z单质完全反应生成ZY2型共价化合物。
(1)X是____________,Y是_____________,Z是_____________(写元素名称)。
(2)写出ZY2的电子式___________________。
(3)写出X元素的最高价氧化物对应水化物的化学式_____________________。
36.氢化钠(NaH)是一种白色的离子晶体,其中钠是+ l价, NaH与水反应放出氢气。
⑴NaH中氢离子的电子层排布与____________________原子相同。
⑵NaH中氢离子半径比锂离子________(大或小)。
⑶NaH与水反应时,_____________是还原剂。
⑷NaH与水反应后,所得溶液显_________________(酸性或碱性)。
37.X、 Y、 Z三种短周期元素, X原子半径是所有元素中最小的,Y的最外层电子数比次外层多4个电子,Z的化合物进行焰色反应时火焰为黄色;又知Z、Y形成甲、乙两种固体的化合物,甲中Z和Y的原子数比为2:1,乙中Z和Y的原子数比为1:1。则:
⑴X、Y、Z分别为:X__ ____、Y__ ____、Z__ ____;
⑵甲、乙化学式分别为______ ____;
⑶Z的原子结构示意图为________________________________。
38.下表是元素周期表前三周期部分元素所在周期表中的位置:
| A | IIA | IIIA IVA VA VIA VIIA | |||||
| D | F | H | |||||
| B | C | E | G | ||||
IA 0
(1)A、B、C、D、E、F、G、H中化学性质最不活泼的元素是_______(填元素符
号),其原子的电子式为__________;
(2)比较A、B、E、F原子的原子半径大小:______>_____>_____>______;
(3)写出C的最高价氧化物对应的水化物与G的氢化物的水溶液相互反应的离子方程:
。
39.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M (组成E、G、L、M分子的元素原子序数均小于10) 如下图,
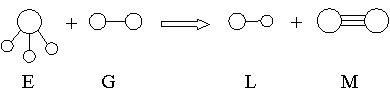

用化学反应方程式表示上述变化为: 。
40.A.、B同一短周期相邻主族的两种金属元素,且A在B的左边,它们的相对原子质量之比为8:9,A、B单质以3:2的物质的量之比混合成为1.28克粉末,与中量的盐酸完全反应后,在标况下生成1.344升氢气,通过计算确定A、B的名称,指出它们在周期表中的位置.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | A | D | A | A | D | C | D | C | D | C | B | C | A | A |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| A | C | B | D | C | B | D | C | C | D | B | A | B | B | D |
31D32 B
40 A是镁B是铝