高二化学秋学期期末考试试卷
高二化学(选修)
说明:1、本试卷总分120分,考试时间100分钟
2、可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Cl:35.5 Ca:40 Fe:56 Cu:64 Zn:65
3、请将选择题的正确答案填写在选择题的答案栏里
第Ⅰ卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列物质的水溶液能导电,但属于非电解质的是 ( C )
A.CH3COOH B.NH4HCO3 C.SO2 D. Cl2
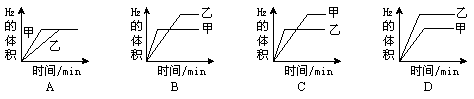
2.将0.01mol相同颗粒大小的镁粉、铁粉分别加入到盛有50mL1mol·L-1硫酸的两烧杯甲和乙中,下图能正确反映实验结果的是 (A )
3.反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),在10L的密闭容器中进行,,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为:( A )
4NO(g)+6H2O(g),在10L的密闭容器中进行,,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为:( A )
A.V(NH3) = 0.0010mol·L-1·S-1 B.V(O2) = 0.0010 mol·L-1·S-1
C.V(NO) = 0.010 mol·L-1·S-1 D.V(H2O) = 0.045 mol·L-1·S-1
4.将pH试纸用蒸馏水湿润后测定某溶液的pH,则测量值与真实值相比较 ( D )
A.偏高 B.偏低 C.不变 D.上述三种情况均有可能
5.爱迪生蓄电池在充电和放电时发生的反应按下式进行:
 |
Fe(OH)2+Ni(OH)2 Fe+NiO2 + 2H2O
由此可知,该电池放电时的负极材料是 ( C )
A.Fe(OH)2 B.Ni(OH)2 C.Fe D.NiO2
6、某可逆反应的正反应是吸热反应,温度对此反应的正、逆反应速率影响的曲线如图所示,其中正确的是(B )
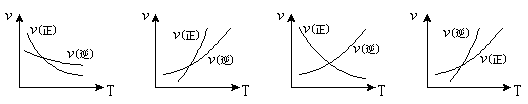
A B C D
7、下列说法正确的是( B)
A.可逆反应的特征是正反应速率总是和逆反应速率相等
B.在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其它条件不变时,升高温度可以使化学平衡向放热反应的方向移动
D.在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
8、以下现象与电化学腐蚀无关的是(D)
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.用敷铜板和氯化铁溶液制作电路板
 二、多项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意,若有错选不得分,若漏选则得2分)
二、多项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意,若有错选不得分,若漏选则得2分)
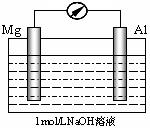
9.关不右图所示装置的说法正确的是:( BD )
A.电流表指针将不会转动
B.外电路中电子流向是Al → Mg
C.Mg是负极,电极反应式为:Mg - 2e- = Mg2+
D.Al是负极,电极反应式为Al + 4OH—- 3e-=AlO2—+2H2O
10、根据下表中列出的数据,判断下列热化学方程式书写不正确的是:( C )
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能 | 436kJ•mol—1 | 243 kJ•mol—1 | 431 kJ•mol—1 |
A.![]() H2(g) +
H2(g) +
![]() Cl2(g) =
HCl(g)
Cl2(g) =
HCl(g) ![]() H=-91.5
kJ•mol—1
H=-91.5
kJ•mol—1
B. H2(g) + Cl2(g) =
2HCl(g) ![]() H=-183 kJ•mol—1
H=-183 kJ•mol—1
C.![]() H2(g) +
H2(g) +
![]() Cl2(g) =
HCl(g)
Cl2(g) =
HCl(g) ![]() H= + 91.5
kJ•mol—1
H= + 91.5
kJ•mol—1
D.2HCl(g) = H2(g) + Cl2(g)
![]() H= + 183
kJ•mol—1
H= + 183
kJ•mol—1
11.下列各组离子在常温下一定能大量共存的是( B )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在强碱溶液中:NH4+、Al3+、SO42—、NO3—
D.在含大量H+的溶液中:K+、Fe2+、Cl—、NO3—
12.下列每个选项中,①②两个反应可用同一离子方程式表示的是 ( B )
A.①稀H2SO4和Na2CO3溶液 ②稀H2SO4和NaHCO3溶液
B.①BaCl2溶液和Na2SO4溶液 ②Ba(OH)2溶液Na2SO4溶液
C.①KOH溶液和NH4Cl溶液 ②Ba(OH)2溶液和(NH4)2SO4溶液
D.①Cu和浓HNO3 ②Cu和稀HNO3
13、对于有气体参加的反应,下列措施均能加快反应速率,其中不是因为增大反应体系活化分子百分数而加快反应速率的是( AB )
A.缩小体积以增加反应体系的压强 B.保持体积不变,增大反应物的浓度
C.升高反应体系的温度 D.加入催化剂
14、下列变化过程中,△S<0的是(A )
A.水蒸气凝结成水滴 B.硝酸铵固体溶于水
C.氮气和氧气混合 D.碳酸氢铵固体分解为NH3、H2O(g)和CO2
15、把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为: ( D )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
16、已知反应mX(g) + nY(g) ![]() qZ(g)的
qZ(g)的![]() H > 0, m+n > q,在恒容密闭容器中反应达到平衡时,下列说法正确的是:
( AB )
H > 0, m+n > q,在恒容密闭容器中反应达到平衡时,下列说法正确的是:
( AB )
A.通入稀有气体使压强增大,平衡不发生移动
B.X的正反应速率是Y的逆反应速率的m ⁄ n倍
C.降低温度,混合气体的平均相对分子质量变大
D.增加X的物质的量,Y的转化率降低
17、用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液。一段时间后,溶液颜色变浅。此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,应向电解后的溶液中加入适量的: ( B )
A.Na2SO4和CuSO4 B.CuO
C.Na2O和CuO D.H2O和CuSO4
18、在一个容积为1L的密闭容器中,加入2mol A和1mol B发生如下反应:
2A(g)+B(g) ![]() 3C(g)+D(s)
3C(g)+D(s)
达到平衡时,C物质的物质的量浓度为1.2mol·L-1。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2mol·L-1的是( CD )
A.4molA+2molB B.3molC+1molD+1molB
C.3molC+0.8molD D.1.6molA+0.8molB+0.6molC+0.3molD
第Ⅱ卷(非选择题 共56分)
选择题答卷栏
| 题号 | 1 | 2 | 4 | 5 | 6 | 7 | 8 | |||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、(本题包括2小题,共15分)
19、(7分)许多反应在通常情况下不能自发进行,在特定条件下(如通电)就能发生。如以铜棒和石墨棒为电极材料,电解饱和食盐水即可实现下列反应:
Cu+2H2O=Cu(OH)2+H2↑。
则铜棒是 极,两极发生反应的反应式分别为:
铜棒 ,石墨 。
20、(10分)实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置进行中和热的实验,得到表中的数据。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
试回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
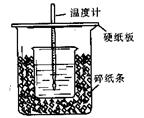 (2)烧杯间填满碎纸条的作用是
。
(2)烧杯间填满碎纸条的作用是
。
(3)经数据处理,t1 - t2 = 3.4℃。则该实验测得的中和热
![]() H = [盐酸和NaOH溶液的密度按1g/mL
H = [盐酸和NaOH溶液的密度按1g/mL
计算,反应后混合溶液的比热容(c)按4.184J/(g·℃)计算]
(4)若将NaOH溶液改为相同体积、相同浓度的氨水,测得的中和热为![]() H1,则
H1,则![]() H1与
H1与![]() H的关系为:
H的关系为:![]() H1
H1 ![]() H
H
(填“<”、“>”或“=”),理由是 。
四、(本题包括4小题,共25分)
21、(4分)A、B、C是三种可溶性的离子化合物,且不含有相同离子,它们的阳离子只可能是K+、Ca2+、Mg2+中的一种;阴离子只可能是NO3-、Cl—、CO32-中的一种。取等质量的三种化合物,配制成相同体积的溶液,其物质的量浓度由大到小的顺序是:A>B>C, 则B物质的化学式是 , A物质中肯定含的离子是 。
22、(4分)发射卫星时可用肼(N2H4)为燃料,用NO2作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ·mol-1
(1)写出肼和二氧化氮反应的热化学方程式 。
(2)又知1mol液态水气化时需吸收44kJ的热量,则16g肼和二氧化氮完全反应生成液态水时放出的热量为 kJ。
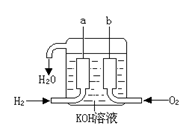 23、(7分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造 如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
23、(7分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造 如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是 极(填“正”或“负”),其电极反 应式为 ,
b极的电极反应式 。
(2)某些碳氢化合物也可作为燃料电池的燃料,如天然气(甲烷)等。若将上图中H2换成CH4时,电池内总的反应方程式为 :CH4+2O2+2OH-=CO32-+3H2O。
请写出a极的电极反应式 。
24、(10分)A、B、C、D均为短周期元素,A、B可形成两种液态化合物B2A2、B2A, A与D可形成气态化合物DA、![]() ;A、B、D可形成一种化学组成为
;A、B、D可形成一种化学组成为![]() 的离子化合物,其为强酸弱碱盐;B与D可形成气体X,B与C可形成气体Y,已知X分子与
的离子化合物,其为强酸弱碱盐;B与D可形成气体X,B与C可形成气体Y,已知X分子与![]() 分子中的电子数相等,Y分子中的电子数与B2A2分子中的电子数相等,X与Y相遇会产生大量白烟。请回答:
分子中的电子数相等,Y分子中的电子数与B2A2分子中的电子数相等,X与Y相遇会产生大量白烟。请回答:
(1)写出X与Y反应所得产物的电子式 。
(2)写出下列反应的化学方程式:
![]() +…
。
+…
。
(3)![]() 的化学式为____________,其水溶液与熟石灰混合加热反应的离子方程式为__________________________________________________。
的化学式为____________,其水溶液与熟石灰混合加热反应的离子方程式为__________________________________________________。
(4)已知液态X与![]() 相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则液态X中的电离方程式为____________________________________________。
相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则液态X中的电离方程式为____________________________________________。
五、(本题包括2小题,共16分)
25、(7分)在500g CuSO4溶液中插入两根电极,一极为铁,另一极为含杂质锌均匀的粗铜,通电一段时间后切断电源,立即将电极取出,这时铁电极增重7.04g,电解质溶液增重0.02g,求粗铜中锌的质量分数。
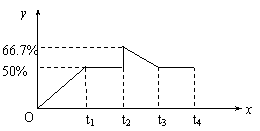
26、(9分)已知:在某温度下,可逆反应X(g)+Y(g) ![]() 2Z(g)的平衡常数为4。在该温度下,向某恒容密闭容器中加入2 mol X和2 mol Y,在t1时刻达到平衡,在t2时刻再向此容器中加入2 mol Z,在t3时刻反应重新达到平衡至t4时刻,通过计算画出0~t4时间段内混合气中Z的体积分数(y坐标)随时间(x坐标)变化曲线。
2Z(g)的平衡常数为4。在该温度下,向某恒容密闭容器中加入2 mol X和2 mol Y,在t1时刻达到平衡,在t2时刻再向此容器中加入2 mol Z,在t3时刻反应重新达到平衡至t4时刻,通过计算画出0~t4时间段内混合气中Z的体积分数(y坐标)随时间(x坐标)变化曲线。
 |
高二化学(选修)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 4 | 5 | 6 | 7 | 8 | |||
| 答案 | C | A | A | D | C | B | B | D |
二、多项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意,若有错选不得分,若漏选则得2分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BD | C | B | B | AB | A | D | AB | B | CD |
三、(本题包括2小题,共15分)
19、(5分)阳(1分) 铜棒:Cu-2e-=Cu2+,(2分)
石墨棒:2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-(2分)
20、(10分,每空2分)
(1)环形玻璃搅拌棒 (2)防止热量散失
(3)—56.8 kJ·mol-1
(符号、热量数值均正确,给2分,有一处错误则不给分,答“—56.8”不给分)
(4)> ![]() 电离吸热
电离吸热
四、(本题包括4小题,共25分)
21、(4分)K2CO3 Cl-
22、(4分,每空2分)
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ·mol-1
(2)327.93
23、(7分)(1)a极是负极(1分)
2H2+4OH――4e-=4H2O(2分) O2+2H2O+4e-=4OH-(2分)
(2)a极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O(2分)
24、(10分,每空2分)(1)![]()
(2)3Cl2+8NH3=N2+6NH4Cl 或3Cl2+2NH3=N2+6HCl
(3)NH4NO3;![]()
![]()
![]()
(4)![]()
![]()
![]()
五、(本题包括2小题,共16分)
25、(7分)参加反应的锌的质量为1.30g(3分)
参加反应的锌和铜的总质量为7.04 g +0.02 g =7.06g(2分)
锌的质量分数为18.4%(2分)
26、(9分)
 设该密闭容器的体积为V L,第一次平衡时(即t1时刻),有a mol 的X转化为Z。
设该密闭容器的体积为V L,第一次平衡时(即t1时刻),有a mol 的X转化为Z。
X(g) + Y(g) ![]() 2Z(g)
2Z(g)
开始时: 2 2 0
变化量: a a 2 a
平衡时:2-a 2-a 2 a
则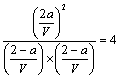 (2分) [若写作
(2分) [若写作![]() 不得分]
不得分]
解之得:a=1 第一次平衡时Z的体积分数为50%(1分)
t2时刻,Z%=![]() ×100%=66.7%(1分)
×100%=66.7%(1分)
由于反应前后气体的分子数不变,所以加入2mol Z重新达到平衡时,Z的体积分数与第一次平衡时相同 ,即为50%(2分)
(作图正确得3分)