高二化学科目学业水平模拟考试
化学试题
说明:本试题共分二卷,第I卷 选择题,其中1—17题为必修内容的选择题,18—21题选修内容的分叉选择题,为共68分;第Ⅱ卷 非选择题,22—24题为必修内容的非选择题,25—26题为选修内容的分叉非选择题,共32分;考生只能在分叉题中任选一个模块作答,多选做者,按照模块呈现的顺序首先作答的计分。考生所作答题目满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32
第I卷(选择题 共68分)
一、选择题(本题有21小题,1—16题,每小题3分,共48分;17—21题,每小题4分,共20分。 每小题只有1个选项符合题意,不选、多选、错选均不给分)
1.创建和谐社会,保护生存环境是每一个公民的责任和义务。下列做法中,有利于保护环境的是 ( )
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③新农村建设中倡导建造沼气池
④推广使用一次性木质筷子,⑤集中掩埋废旧电池
A.①②③ B.②③④ C.①②⑤ D.①④⑤
 2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 ( )
2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 ( )
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
|
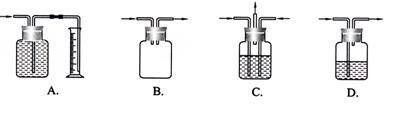
组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是 ( )
4.有关化学用语正确的是 ( )
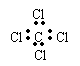 A.乙烯的最简式C2H4
B.乙醇的结构简式C2H6O
A.乙烯的最简式C2H4
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式 D.臭氧的分子式O3
5.下列化学方程式中,不能用H++OH-=H2O表示的是 ( )
A.2NaOH+H2SO4=Na2SO4+2H2O
B.Ba(OH)2+2HCl=BaCl2+2H2O
C.Cu(OH)2+2HNO3=Cu(NO3)+2H2O
D. KOH+HCl=KCl+H2O
6.关于化学键的下列叙述中,正确的是 ( )
A.离子化合物可能含有共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物中一定含有金属离子
7.实验要知其所以然。将铜片和锌片用导线连接后插入番茄里,如下图所示,电流计指针发生偏转,锌片是 ( )
 A.阳极 B.正极
A.阳极 B.正极
C.阴极 D.负极
8.下列关于物质用途的叙述中,不正确的是 ( )
A.硅可以用作制造变压器的铁芯材料
B.二氧化硅可用于制造光导纤维
C.石墨可用做绝缘材料
D.石英玻璃可用于制造光学仪器
9.按下图装置,持续通入X气体,可以看到a处有红棕色物质生成,b处变蓝,c处得到液体,则X气体是 ( )
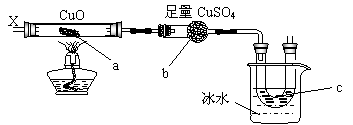 |
A.H2 B.CO和H2 C.NH3 D.CH3CH2OH(气)
10.在2A(g)+B(g)![]() 3C(g)+4D(g)中,下列情况能够降低该反应速率的是( )
3C(g)+4D(g)中,下列情况能够降低该反应速率的是( )
A.增大压强 B.降低温度 C.使用催化剂 D.增大A的浓度
11.在实验室里,欲用98%的浓硫酸(密度为1.84g/mL)配置成浓度为0.5mol/L的稀硫酸500mL。选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和 ;所需浓硫选的体积为 mL;如果实验室有15mL、20mL、50mL的量筒,应选用 mL。以下组合正确的是 ( )
A.容量瓶、13.6 、15 B.500 mL容量瓶、15、50
C.容量瓶、12 、 20 D.500 mL容量瓶、13.6、15
12.核磁共振(NMR)技术已经广泛应用于分子结构的测定和医学诊断扥高科技领域,一
直只有质子数或中子数为奇数的原子核才有NMR现象,判断下列哪组原子都能产生NMR
现象 ( )
A.18 O 32 S B.2 H 4 He C.14 N 31 P D.14 C 32 Si
13.相同浓度的溶液:Na2CO3、NaAlO2、Na2SiO3、Na2SO4,可用下列一种试剂在常温下
鉴别的是 ( )
A.BaCl2溶液 B.稀H2SO4 C.CO2气体 D.AgNO3溶液
14.在pH=1的溶液中,可以大量共存的离子是 ( )
A.K+、Na+、SO42-、CO32-
B.NH4+、Mg2+、SO42-、Cl-
C.Na+、K+、HCO3-、Cl-
D.K+、Na+、AlO2-、NO3-
15.下列各组元素性质活原子结构递变情况错误的是 ( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次增大
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数依次增多
16.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的离子中含有的电子数为0.1NA
C.常温常压下,11.2L氧气中所含有的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
17.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+
考生注意:18—21题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用《化学与生活》教材的考生解答,B题适合使用《有机化学基础》教材的考生解答。
18.(A)市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹以及人体排放的蛋白质油渍遇到它,都能水解而被除去,下列衣料中不能用及酶洗衣粉洗涤的是 ( )
①棉织品 ②毛织品 ③腈纶制品 ④蚕丝制品 ⑤涤纶制品 ⑥锦纶制品
A.①②③ B.②④ C.③④⑤ D.③⑤⑥
(B) (CH3CH2)2CHCH3的正确命名是 ( )
A 2-甲基戊烷 B 3-甲基戊烷 C 2-乙基丁烷 D 3-乙基丁烷
19.(A)下列广告用语在科学性上没有错误的是 ( )
A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.没有水就没有生命
D. 这种口服液含丰富的氮、磷、锌等微量元素
(B)能用酸性高锰酸钾溶液鉴别的一组物质是 ( )
A.乙烯 乙炔 B.苯 己烷 C.苯 甲苯 D. 己烷 环己烷
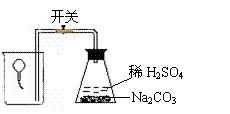 20.(A)为测定气球内的气体成分,有学生用超薄材料的气球按图
20.(A)为测定气球内的气体成分,有学生用超薄材料的气球按图
装置进行实验。开始时气球沉于烧杯底部,打开开关后,过
一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内
可能的气体是 ( )
A.甲烷 B.氢气 C.氯气 D. 氧气
(B)某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,此烷烃是( )
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH3
21.(A)下列家庭小实验最合理的是 ( )
A.将适量的苏打粉放在容器中加热,观察气体的产生
B.在洁净的水杯中先加入小苏打粉,再加入食醋,观察气体的产生
C.往稀白粥中加入少量加碘食盐,检验加碘食盐中含有I2
D.在一瓣橘子上插入两根铜线并与小灯泡连接,验证电流的产生
(B)“喷水溶液法”是一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水的作用。下列关于聚丙烯酸酯的说法错误是 ( )
A.单体的结构式为CH2=CH—COOR
B.有固定的熔沸点
C.在一定条件下能发生水解反应
D.由单体合成聚丙烯酸酯属加聚反应
请将选择题答案填入答题框内
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共32分)
二、(本题共3小题,为必修内容,共20分)
22.(6分)(1)将乙烯通入到溴的四氯化碳溶液中,反应的现象为 ,
产物的结构简式是 ,反应类型是 。
(2)写出实验室制取乙酸乙酯的化学方程式:
,
该反应的类型是 ,其中浓硫酸的作用是 。
 23.(6分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,甲是工业上制取A的主要原料。请回答:
23.(6分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,甲是工业上制取A的主要原料。请回答:
(1)写出下列物质的化学式:A 、甲 、乙 、丁 ;
(2)写出甲物质在工业上的任两种主要用途: ;
(3)写出丁与过量氨水反应的离子方程式: 。
24.(8分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
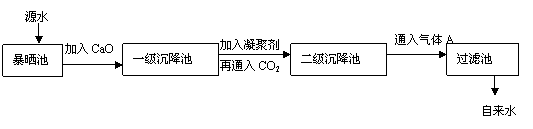
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若
干复分解反应,试写出其中的一个离子方程式 。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是 。(填写下列各项的序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状
沉淀是 。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。
(5)下列物质中, 可以作为气体A的代替品。(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
三、(本题共两小题,为选修修内容,共12分)
考生注意:25—26题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用《化学与生活》教材的考生解答,B题适合使用《有机化学基础》教材的考生解答。
25.(A)(4分)钢铁的生产与使用是人类文明和生活进步的一个重要标志,我们每年向自然界索取大量的金属矿物资源。而全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。随着金属材料使用量的增加和矿物资源的紧缺,人们对资源保护的意识日趋增强。
(1)保护金属资源的有效途径为(任写出两条)
(2)取6根铁钉,6支干净的试管及其它材料,准备如下图,试管(1)放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;

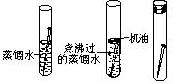
试管(2)先放入一根铁钉,趁热倒入煮沸的蒸馏水(赶出原先溶液在蒸馏水中的空气)浸没铁钉,再加上一层机油(矿物质油),使铁钉不能跟空气接触.
试管(3)的试管底放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触.
试管(4)中放入铁钉注入食盐水,使铁钉和空气及食盐水接触.
试管(5)放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片.
试管(6)放入相连的铁钉和铜丝,注入自来水浸没铁钉和铜丝.
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况.其中__ ____试管内的铁钉未被腐蚀.
从铁钉被腐蚀的情况可知引起和促进铁钉腐蚀的条件是_ ____。
 (B)(4分)在①CH3CHO ②CH3CH2OH ③ ④CH3COOC2H5
⑤CH3COOH五种物质中
(B)(4分)在①CH3CHO ②CH3CH2OH ③ ④CH3COOC2H5
⑤CH3COOH五种物质中
(1)能与NaOH溶液反应的有 (填序号,下同);
(2)能发生银镜反应的有 ;
(3)既能发生酯化反应,又能发生消去反应的有 。
(4)从上述反应中任选一个,写出化学方程式
26.(A)(8分)化学与人类生活息息相关。
(1)利用化学合成药物,可保障人体健康。有的治疗胃酸过多的药物中含有氢氧化铝[Al(OH)3],用化学方程式表示氢氧化铝与胃酸的反应 。
(2)糖尿病是老年人易患的一种常见病,常表现为尿糖含量高,控制尿糖,就可控制 病情。有一种尿糖检测试纸,将试纸浸入鲜尿中,取出后,以试纸颜色变红的程度,与标准色卡进行比较,以确定尿糖的浓度,简要回答:
①尿糖试纸是将滤纸剪成小条,在一种浊液中浸润,在一定条件下干燥而成。指出该重浊液中的最主要化学成分是 。判断浊液显 (填“酸性”或“碱性”)。
②这种检测尿糖的方法原理是 ,写出反应的化学方程式:
。
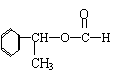
(B)(8分)化学式为C8H10O的化合物A 具有如下性质:
①A+Na→慢慢产生气泡 ②A+RCOOH![]() 有香味的产物
有香味的产物
③A![]() 苯甲酸 ④催化脱氢产物不能发生银镜反应
苯甲酸 ④催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是 (多选扣分);
A.苯环上直接连有羟基 B.肯定有醇羟基
C.苯环侧链未端有甲基 D.肯定是芳香烃
(2)化合物A的结构简式 ;
(3)A发生催化脱氢反应的化学方程式 ;
(4)A与甲酸反应生成的酯的结构简式为 。
命 题:戴 乐
审 校:赵志明
化学科答案及评分标准
一、选择题(本题有20小题,1—16题,每小题3分,共48分;17—21题,每小题4分,共20分。 每小题只有1个选项符合题意,不选、多选、错选均不给分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案
| A | D | B | D | C | A | D | C | C | B | D |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
| 答案 | C | B | B | C | A | C | B | C | D | B |
二、(本题共3小题,为必修内容,共20分)
22.(6分)(1)溶液由橙红色褪为无色 Br—CH2—CH2—Br 加成反应
(2)CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 酯化反应或取代反应 作催化剂和吸水剂
CH3COOCH2CH3+H2O 酯化反应或取代反应 作催化剂和吸水剂
23.(6分)(1)Al、Al2O3、NaAlO2、AlCl3
(2)手表轴承、耐火材料
(3)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
24.(共8分,第一空2分,其它每空1分)
(1)只要写出下列4个离子方程式中的任意一个,即可给2分。
![]()
![]() HCO-3+OH- CO2-3+H2O;Ca2++CO32-+OH- CaCO3↓+H2O;
HCO-3+OH- CO2-3+H2O;Ca2++CO32-+OH- CaCO3↓+H2O;
![]() Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
![]() Mg2++2OH- Mg(OH)2↓
Mg2++2OH- Mg(OH)2↓
(2)③;Fe(OH)3
(3)除去钙离子;调节溶液酸度
(4)杀菌消毒或氧化性
(5)①
三、(本题共2小题,为选修修内容,共12分)
25.(共4分)
(A)(1)保持表面光洁、干燥,土矿物油;涂防锈漆;合理利用金属资源,寻找替代品等
(2)铁钉未被腐蚀的试管是:(2)(3)(5);引起和促进铁钉被腐蚀的条件是:水、空气、电解质溶液,不活泼金属杂质的存在.
(B)(1)③④⑤ (2)① (3)②

 (4)只要写出下列6个方程式中的任意一个,即可给分。
(4)只要写出下列6个方程式中的任意一个,即可给分。
+ NaOH → + H2O
CH3COOC2H5 + NaOH → CH3COONa +C2H5 OH
CH3COOH + NaOH → CH3COONa + H2O
CH3CHO + 2 Ag (NH3)2 OH → CH3COONH4 + 2 Ag↓+3 NH3 + H2O
![]() CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH![]() CH3COOCH2CH3
+ H2O
CH3COOCH2CH3
+ H2O
CH3CH2OH CH2=CH2 + H2O
26.(共8分)
(A)(1)Al(OH)3+3HCl=AlCl3+3H2O
(2)①Cu(OH)2 碱性 ②葡萄糖将Cu(OH)2还原成红色的Cu2O
CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH4)COOH+Cu2O↓+2H2O
CH2OH(CHOH4)COOH+Cu2O↓+2H2O
(B)![]() (1)BC (2)
(1)BC (2)
 (3)
(3)
 |
(4)