高二化学下学期期末联合考试
高 二 化 学 试 题
注意事项:
1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。卷面总分100分,考试时间90分钟。
2、考生将第Ⅰ卷每小题答案选出后,将答案序号涂在答题卡上。考试结束,只交答题卡和第Ⅱ卷。
3、相对原子质量:H:1;O:16;C:12;Fe:56;Cu:64;Cl:35.5;S:32
第Ⅰ卷(选择题)
一、选择题(每题只有一个答案符合题意 共2×25=50分)
1.生活中的一些问题常涉及到化学知识,下列叙述不正确的是:
A.糯米中的淀粉发生水解反应,生成乙醇
B.食醋中的溶质主要成分是醋酸
C.棉花和人造丝的主要成分都是纤维素
D.室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染空气
2.下列说法不正确的是:
A.油脂属于高分子化合物 B.天然蛋白质水解的最终产物都是a—氨基酸
C.CuSO4溶液会使蛋白质变性 D.油脂水解的共同产物是甘油
3.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是:
A.Cl-、Mg2+、SO![]() 、K+ B.NH
、K+ B.NH![]() 、Cl-、Na+、Ba2+
、Cl-、Na+、Ba2+
C.SO![]() 、Cl-、CO
、Cl-、CO![]() 、Na+
D.HCO
、Na+
D.HCO![]() 、K+、NO
、K+、NO![]() 、SO
、SO![]()
4.2005年美国遭受飓风袭击,整个新奥尔良都浸泡在水中。灾区的灾民欲将海水转化为可饮用水,除了要降低盐分外,还要进行下列处理,其合理的顺序是: ①化学沉降(用明矾)②消毒杀菌(用漂粉精)③自然沉降 ④加热煮沸
A.①②③④ B.③①②④ C.③①④② D.①③④②
5.丙烯酸的结构简式为CH2=CH—COOH,对其性质的描述不正确的是:
A.能与金属钠反应放出氢气 B.不能与新制氢氧化铜反应
C.能发生加聚反应生成高分子化合物 D.能使溴水褪色
6.相同温度、相同物质的量浓度的下列4种溶液: ①CH3COONa ②NaHSO4 ③NaCl ④C6H5ONa,按pH由大到小的顺序排列正确的是:
A.④>①>③>② B.①>④>③>② C.①>②>③>④ D.④>③>①>②
7.某物质中可能有甲醇、甲酸、乙醇、甲酸乙酯几种物质中的一种或几种,在鉴定时有下列现象:①有银镜反应 ②加入新制Cu(OH)2悬浊液,沉淀不溶解,③与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色,下列叙述中正确的是:
A.一定有甲酸乙酯和甲酸 B.一定有甲酸乙酯和乙醇
C.一定有甲酸乙酯,可能有甲醇和乙醇 D.几种物质都一定有
8.下列实验的失败是因为缺少必需的实验步骤造成的是:
①锌与稀硫酸反应制取氢气,用排水法收集不到氢气;②实验室用无水乙醇和浓硫酸共热140℃制取乙烯时得不到乙烯;③验证RX是碘代烷,把RX与NaOH水溶液混合后,加入AgNO3溶液出现褐色沉淀;④做醛的还原性实验时,当加入新制的Cu(OH)2悬浊液加热后,未出现红色沉淀;⑤检验淀粉己水解,将淀粉与少量稀H2SO4加热一段时间后,加入银氨溶液后未出现银镜
A.③⑤ B.③④⑤ C.①③④⑤ D.①②③④⑤
9.下列物质中,属于天然高分子化合物的是:
A.聚乙烯 B.蔗糖 C.淀粉 D.麦芽糖
10.关于蛋白质的叙述不正确的是:
A.人工合成具有生命活性的蛋白质——结晶牛胰岛素是我国科学家1965年首次合成的
B.在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,若再加水,也不溶解
C.重金属盐类能使蛋白质凝结变性,所以误食重金属盐能使人中毒
D.浓HNO3溅在皮肤上能使皮肤呈现黄色,是由于浓HNO3和蛋白质发生了颜色反应
11.下列原料或制成的产品中,若出现破损不可以进行热修补的是:
A.聚氯乙烯凉鞋 B.电木插座
C.自行车内胎 D.聚乙烯塑料膜
12.乙酸乙酯、甲酸甲酯、乙酸丙酯三种物质组成的混合酯中,若氧元素的质量分数为30%,那么氢元素的质量分数可能是:
A.10% B.20% C.30% D.40%
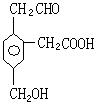 13.某有机物的结构简式如右图所示:在一定条件下,该物质可能发生的反应有:①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
13.某有机物的结构简式如右图所示:在一定条件下,该物质可能发生的反应有:①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A.②③④ B.①③⑤⑥
C.①③④⑤ D.②③④⑤⑥
14.将一定量的有机物充分燃烧后的全部产物通入足量石灰水中,完全被吸收,经过滤得到沉淀20g,滤液质量比原石灰水减少5.8g,该有机物可能是:
A.乙烯 B.甘油 C.乙醇 D.甲酸甲酯
15.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是:
A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
16.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式正确的是:
A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(l) △H= +890kJ·mol—
B.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= +890kJ·mol—
C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H=-890kJ·mol—
D.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890kJ·mol—
17.下列说法正确的是:
A.化学反应中的能量变化都表现为热量的变化 B.需要加热才能发生的反应一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小
18.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于:
A.分子晶体 B.原子晶体 C.离子晶体 D.何种晶体无法判断
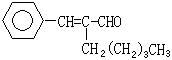 19.茉莉醛具有浓郁的茉莉花香,其结构简式如下图所示:
19.茉莉醛具有浓郁的茉莉花香,其结构简式如下图所示:
关于茉莉醛的下列叙述错误的是:
A.在加热和催化剂作用下,能被氢气还原
B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应
D.不能与氢溴酸发生加成反应
20.某同学按右图所示的装置进行电解实验。下列说法正确的是:
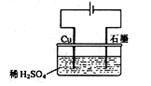 A.电解过程中,铜电极上有H2产生
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
21.下列说法正确的是:
A.原子晶体中只存在非极性共价键 B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
 D.金属元素和非金属元素形成的化合物一定是离子化合物
D.金属元素和非金属元素形成的化合物一定是离子化合物
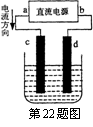
22.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是:
A.a为正极、b为负极
B.a为阳极、b为阴极
C.电解过程中,d电极质量不变
D.电解过程中,氯离子浓度不变
23.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若分子中氧的质量分数为50%,则含C原子个数最多为:
A.4 B.5 C.6 D.7
24.以惰性电极电解CuSO4溶液,若阳极析出气体0.01mol,则阴极上析出Cu为:
A.0.64g B.1.28g C.2.56g D.5.12g
25.下列有关工业生产的叙述正确的是:
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
第Ⅱ卷(非选择题)
班级: 姓名:
26.(14分)奶油中有一种只含C、H、O的化合物A 。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
⑴A的分子式为___________。
⑵写出与A分子式相同的所有酯的结构简式:
_________________________________________________________________________。
已知: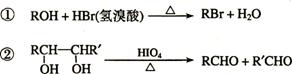
A中含有碳氧双键,与A相关的反应如下:
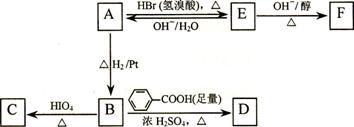
⑶写出A → E、E → F的反应类型:A → E ___________、E → F ___________。
⑷写出A、C、F的结构简式:A _____________、C ____________、F ___________。
⑸写出B → D反应的化学方程式:_________________________________________。
⑹在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________。A → G的反应类型为_________。
27.(6分)已知在同一碳原子上连有两个羟其的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。
 |
⑴条件2中试剂为 。
⑵写出苯甲醛与新制Cu(OH)2浊液反应的化学方程 。
⑶苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式 。
 28.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
28.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
(1)电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是 。
(2)Y电极上的电极反应式为 ___ ____________;
检验该电极反应产物的方法是 __。
29.(10分)A、B、C、D、E、F、G均为有机化合物,他们有如下转化关系:
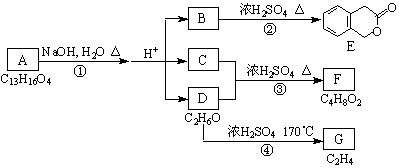
⑴D的化学名称是 。
⑵反应③的化学方程式是 。
(有机物须用结构简式表示)
⑶B的分子式是 ,A的结构简式是 ,反应①的反应类型是 。
⑷B有多种同分异构体,符合下列三个条件的B的同分异构体数目是 个。
①含有邻二取代苯环结构;②与B具有相同的官能团;③不可与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式 。
⑸G是重要的工业原料,用化学方程式表示G的一种工业用途 。
30.(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
 CH3COOH+C2H5OH
CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
⑴欲提高乙酸的转化率,可采取的措施有 、
等。
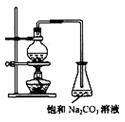
⑵若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
⑶此反应以浓硫酸为催化剂,可能会造成 、 等问题。
⑷目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
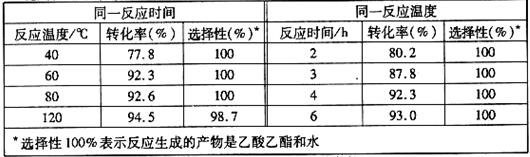 |
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为
31.(14分)黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O == SO2- + 2Fe2+ + 4H+
Cr2O![]() + 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
高二化学试题参考答案及评分准则
一、选择题答案(每小题只有一个选项符合题意,每小题2分,共50分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | A | A | D | B | B | A | C | B | C | B | B | A | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | C | C | C | D | A | C | B | B | A | B | B | D |
26.(14分)
⑴C4H8O2 (1分)
⑵CH3CH2COOCH3 CH3COOCH2CH3
HCOOCH(CH3)2 HCOOCH2CH2CH3 (各1分,共4分)
⑶取代反应 消去反应 (各1分,共2分)
⑷![]() CH3CHO
CH3CHO ![]() (各1分,共3分)
(各1分,共3分)
⑸![]() (2分)
(2分)
⑹![]() (1分)
(1分)
氧化反应 (1分)
27.(每小题2分,共6分)
⑴NaOH溶液
⑵C6H5—CHO+2Cu(OH)2![]() C6H5—COOH+Cu2O↓+2H2O
C6H5—COOH+Cu2O↓+2H2O
![]() ⑶
⑶
28.(8分)
⑴2NaCl + 2H2O==2NaOH + Cl2↑+ H2↑; 酚酞变红,有气泡产生。
⑵2Cl- - 2e- == Cl2↑,用湿润的淀粉碘化钾试纸放在Y极附近观察现象
29.(10分)
⑴ 乙醇 (1分)
⑵ CH3COOH+C2H5OH![]() CH3COOC2H5+H2O (2分)
CH3COOC2H5+H2O (2分)
⑶ C9H10O3 ![]() 水解反应 (各1分,共3分)
水解反应 (各1分,共3分)
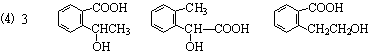 (填写其中一个结构简式即可)
(各1分,共2分)
(填写其中一个结构简式即可)
(各1分,共2分)
⑸
![]()
或CH2=CH2+H2O![]() CH3CH2OH(写任一个合理的反应式均可) (2分)
CH3CH2OH(写任一个合理的反应式均可) (2分)
30.(12分)
⑴增大乙醇的浓度、移出生成物。 (2分)
⑵原料来不及反应就被蒸出、反应温度过高,发生了副反应、冷凝效果不好,部分产物挥发了。(任意写两种即可) (2分)
⑶产生大量的酸性废液(或造成环境污染)、部分原料炭化、催化剂重复使用困难,催化效果不理想。(任意写两种即可) (2分)
⑷①C;(2分)②乙醇脱水生成乙醚。(2分)
31.(14分)
⑴.90.00% (4分)
⑵.SO3(g) + H2O⑴ == H2SO4⑴;△H == -130.3 kJ/mol (2分)
⑶.3.36 × 106 (3分)
15 (3分)
3.43×107 (4分)