高二化学下期竞赛试题
时量90分钟,满分100分,请考生把选择题答案填入答题卡内。可能用到的相对原子质量数据有:Cu—64 Al—27 Fe—56 O—16 H—1
第一卷 (选择题:每小题3分,共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.《科学》杂志评出某年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A.水的电离过程是放热的过程 B.盐的水解一定能促进水的电离
C.催化剂能提高水分解的转化率 D.金属的电化腐蚀与水无关
2.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是
A.0.1mol·L-1的亚硝酸溶液的pH约为2
B.100mL 1mol·L—1的亚硝酸溶液恰好与100mL 1mol·L—1的NaOH溶液完全应
C.用亚硝酸溶液作导电性试验,灯泡很暗
D.HNO2溶液与NaCl溶液不能发生反应
3.某溶液中加入铝粉后,能放出大量H2,那么该溶液中一定能大量存在的离子组是
A.K+、AlO2![]() 、OH
、OH![]() 、
、![]() B.Na+、K+、Ba2+、Cl
B.Na+、K+、Ba2+、Cl![]()
C.![]() 、Ba2+、K+、Cl
、Ba2+、K+、Cl![]() D.Na+、S
D.Na+、S![]() 、
、![]() 、Cl
、Cl![]()
|
A.不变 B.增大 C.减小 D.无法判断
5、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后,c(X2)为0.4mol/L,c(Y2)为0.8mol/L,生成的Z为0.4mol/L,则该反应式是
A、X2+2Y2![]() 2XY2
B、2X2+Y2
2XY2
B、2X2+Y2![]() 2X2Y
2X2Y
C、3X2+Y2![]() 2X3Y
D、X2+3Y2
2X3Y
D、X2+3Y2![]() 2XY
2XY
6.下列说法中正确的是
A.测定溶液的pH,先将pH试纸用蒸馏水润湿
B.称量加热后的固体时,均需先将固体在空气中冷却
C.配制一定物质的量浓度溶液时,容量瓶应先用试剂润洗
D.皮肤上沾有少量浓硫酸,可立即用大量水冲洗
7.下列各反应的化学方程式中,属于水解反应的是
A、H2O+H2O![]() H3O++OH-
B、HCO3-+OH-
H3O++OH-
B、HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
C、CO2+H2O![]() H2CO3
D、CO32-+H2O
H2CO3
D、CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
8.某消毒液无色,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
A.KMnO4 B.NaClO C.H2O2 D.Cl2
9.下列离子方程式中正确的是
A.硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+ ==BaSO4↓
B. 铜片加入稀硝酸中:3Cu +2NO3- + 8H+== 3Cu2+ + 2NO↑ + 4H2O
C. FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2 ==Br2+4Cl-+2Fe3+
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
2HCO3- + Ba2+ +2 OH-== BaCO3↓ +2 H2O+CO32-
10、把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A、Al3+ B、Al(OH)3 C、AlO2- D、Al3+和Al(OH)3
11、将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A、溶液的pH增加 B、CH3COOH电离程度变大
C、溶液的导电能力减弱 D、溶液中c(OH-)减小
12、将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A、0.1mol/L B、0.05mol/L C、0.2mol/L D、无法计算
13、相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是
A、电离程度:HCN>HClO B、溶液的pH:HCN<HClO
C、与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HCN<HClO
D、酸根离子浓度: C(CN-)<C(ClO-)
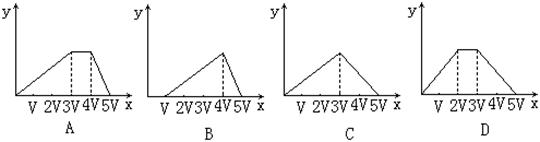 14、将物质的量相等的硫酸铝和硫酸铵溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
14、将物质的量相等的硫酸铝和硫酸铵溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
15、将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2即可产生电流,称为燃料电池。下列叙述不正确的是
A、通氧气的电极为正极 B、正极的电极反应式为:O2+2H2O+4e-=4OH-
C、通甲烷的电极反应式是:CH4+2O2+4e-=CO2+2H2O
D、负极的电极反应式是:CH4+10OH--8e-=CO32-+7H2O
16.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后
的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2
或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型
与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
第二卷 (共52分)
二、(本题包括1小题,共12分)
17.(12分)为测定空气中二氧化碳的含量,进行下列实验:
①配制0.1000mol/L的标准盐酸和0.01000mol/L的标准盐酸 ②用0.1000mol/L的标准盐酸滴定未知的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL ③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线。取出稀释后的全部溶液放入密闭容器内,并通人10.0L标准状况下的空气,振荡,这时生成沉淀 ④过滤上述所得浊液 ⑤取滤液20.00 mL,用0.01000mol/L的标准盐酸滴定,用去盐酸34.80 mL。 请回答下列问题:
(1) 配制标准盐酸时,需用下列哪些仪器
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒
E.烧杯 F.胶头滴管 G.玻璃棒
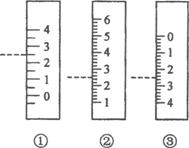
(2) 右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是
A.①是量筒,读数为2.5mL B.②是量筒,读数为2.5mL
C.③是滴定管,读数为3.5mL D.②是温度计,读数是2.5℃
(3) 进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
(4) Ba(OH)2溶液的物质的量浓度是 mol/L
(5) 此空气样品中含CO2的体积分数是
(6) 本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,会使最终测定结果 (填“偏大”或“偏小”或“无影响”)
三、(本题包括4小题,32分)
18.(8分)位于短周期五种主族元素A、B、C、D、E原子序数依次增大,已知A、D位于同一主族,C、E的最外层电子数相等,且C、E的原子序数之和为A、D原子序数之和的两倍,B的最高正价与最低负价绝对值之差为2,根据你的推断回答下列问题:
(1)写出下列元素的名称:A、
(2)写出含C元素质量分数最高的化合物的电子式 ;
(3)由A、B两种元素组成的离子化合物A5B水溶液呈碱性,试用化学方程式表示该溶液呈碱性的原因 。
(4)分别由A、C、D、E四种元素组成的化合物x和y之间的离子反应方程式为 。
19.(10分)在一个固定体积的,向容器中充入2 mol A和1 mol B,发生如下反应:
2A(g)
+ B(g) ![]() 3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
⑴若使容器温度升高,平衡时混合气体的平均摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.3 mol C
⑶某温度下,在1L密闭容器中,若反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是_________(用序号填空)
A、大于零即可 B、大于0.6mol C、大于或等于1mol D、任意值
(4)某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
20.(8分)A→J均为中学化学中的常见物质,它们之间的转化关系如下图所示。已知A、C、H、I、J含有同一种元素,B、D、E、F、G含有同一种元素。
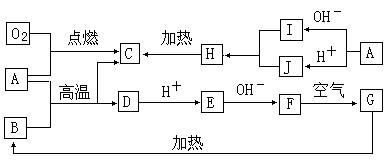
请填写下列空白:
(1) H的化学式是 ;
(2)A生成I反应的离子方程式是 ;
(3)A和B发生反应的化学方程式是:________ ________;
⑷工业上冶炼D的方法是: 。
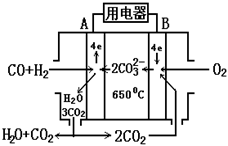 21.(6分)熔融碳酸盐燃料电池(MCFS),发明于1889
21.(6分)熔融碳酸盐燃料电池(MCFS),发明于1889
年,上世纪的30~60年代在荷兰得到广泛的发
展,而且建成了寿命超过40000小时的电池,
可应用于中心电站。
现有一个碳酸盐燃料电池,以一定比例
Ll2CO3和Na2CO3低熔混合物为电解质。操作温
度为650℃,在此温度下以镍为催化剂,以煤
气(CO、H2)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为 极,该极发生的电极反应为 ;
(2)电池总反应为____________ ________________。
四、(本题包括1小题,共8分)
22.(8分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:(已知:2Fe3++Cu=2Fe2++Cu2+)
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
|
| ① | ② | ③ | ④ | ⑤ | ⑥ |
| 溶液中 的离子 |
| Fe2+ |
| Fe2+ Cu2+ |
| Fe3+ Cu2+ |
| 残留固 体成分 | Fe Cu |
| Cu |
|
|
|
(2)当溶液中金属离子只有Fe2+ 、Cu2+时,求b的取值范围。
![]()
 答卷
答卷
第一卷 (选择题共48分)
一、(本题包括16小题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第二卷 (共52分)
二、(本题包括1小题,共12分)
17.(12分) (1) (2) (3)
(4) (5) (6)
三、(本题包括4小题,32分)
18.(8分) (1) (2)
(3)
(4) (每空2分)
19.(10分) ⑴ ⑵
⑶ (4)
20.(8分)(1) (2)
(3) (4)
21.(6分)(1)
(2)
四、(本题包括1小题,共8分)
22.(8分) (1)(4分)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的离子 |
|
|
|
| ||
| 残留固体成分 |
|
|
|
|
|
(2)(4分)
湖南省绥宁二中2006年下学期高二化学竞赛参考答案
第一卷 (选择题共48分)
一、(本题包括16小题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | A | B | C | C | D | D | B | B | C | A | A | D | A | C | D |
第二卷 (共52分)
二、(本题包括1小题,共12分)
17.(12分) (1)BCEFG (2)B (3)D (4)0.0980 (5)0.0246% (6)偏大
三、(本题包括4小题,32分)
18.(8分) (1)氢 (2)
(3)NH4H+H2O==NH3·H2O+H2↑
NH3·H2O![]() NH4++OH
NH4++OH![]()
(4)HSO3-+H+==H2O+SO2↑(每空2分)
19.(10分) ⑴吸热 ⑵③ ⑶B (4)0.5 2.5
20.(8分)(1) Al(OH)3 (2)2Al+2OH-+2H2O=2AlO2-+3H2↑
|
|
四、(本题包括1小题,共8分)
22.(8分) (1)(4分)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的离子 | Fe2+ |
| Fe2+ Cu2+ |
| Fe2+ Cu2+ Fe3+ |
|
| 残留固体成分 |
| Cu |
|
|
|
|
(2)(4分)
3Cu+8HNO3=3 Cu(NO3)2+2NO↑+4H2O
ax 8ax/3
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
a(1-x) 8a(1-x)/3
总消耗硝酸的物质的量n(HNO3)=8a/3
所以:8a(1-x)/3<b≤8a/3