高二级化学学业水平测试模拟试题
化 学 (必 修)
(考试时间75分钟 满分100分)
本试卷分为第I卷和第II卷两部分
可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
第I卷(选择题,共69分)
一、单项选择题 在每题的四个选项中,只有一个选项符合要求(本大题17题,每题3分,共51分)
1.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”, 他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同一种物质 B.同分异构体
C.同位素 D.同素异形体
2.下列化学用语正确的是
![]() A.乙烯的结构简式:CH2CH2 B.氮气的结构式:N
A.乙烯的结构简式:CH2CH2 B.氮气的结构式:N![]() N
N
![]() C.水分子的电子式:
D.硫原子的结构示意图:
C.水分子的电子式:
D.硫原子的结构示意图:
3.下列各组物质按酸、碱、盐分类顺次排列。正确的是
A.硫酸、纯碱、石膏 B.氢硫酸、烧碱、明矾
C.硝酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
4.下列关于0.3mol /L的MgCl2溶液的说法中,正确的是
A.100 mL该溶液中含有Mg2+、Cl—总数为0.3NA
B.100 mL该溶液中含有Mg2+数目是0.1NA
C.1 L该溶液中Mg2+的浓度是0.3 mol / L
D.1.5 L该溶液中含有Cl—的浓度是4.5mol / L
5.下列反应中,HCl作还原剂的是
A.NaOH + HCl ==NaCl
![]() B.Zn + 2HCl ==ZnCl2
+ H2 ↑
B.Zn + 2HCl ==ZnCl2
+ H2 ↑
C.MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
D.CuO +2HCl ==CuCl2 + H2O
6.下列各组离子在溶液中可大量共存的是
A.K+,Cl—,CO32-,Na+ B.H+,Ba2+,NO3-,SO42-
C. NH4+,SO42-,K+,OH- D.Ca2+,NO3-,Na+,CO32-
7.下列离子方程式中正确的是
A.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42—=BaSO4↓
B.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
C.金属钠投入水中 Na + 2H2O = Na+ + 2OH- + H2↑
D.稀硫酸和氢氧化钠溶液混合:H+ + OH— ═ H2O
8.消毒液在日常生活中被广泛应用。某消毒液无色,pH>7,对某些有色物质有漂白作用。你认为它可能的有效成分是
A.Na2CO3 B.NaClO C.KMnO4 D.NaCl
9.取等物质的量的镁粉和铝粉混合,再将混合物平均分为四份,分别加入足量的下列溶液中,充分反应后放出氢气最多的是
A.3mol/L的HCl B.4mol/L的HNO3
C.8mol/L的NaOH D.18mol/L的H2SO4
10.关于某溶液所含离子检验的方法和结论正确的是
A.加入BaCl2溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有SO42-
B.加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有Cl-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中可能有CO32-或SO32-
D.加入NaOH并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液是铵盐溶液
11.要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为
①加入足量氯水,②加入足量碘水,③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
12.光纤通信是一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的
A.碳 B.石英 C.锗 D.硅
13.能够用于鉴别SO2和CO2的溶液是
A.石蕊试液 B.品红溶液 C.澄清石灰水 D.氯化钡溶液
14.下列各组物质相互反应得到Al(OH)3的是
A.A12(SO4)3和过量的NH3·H2O B.Al(NO3)3跟过量的NaOH溶液
C.A12O3和水共热. D. Al跟过量的NaOH溶液共热
15. 下列关于烃的说法中,正确的是
A.烃是指分子里含有碳、氢元素的化合物
B.烃是指分子里含碳元素的化合物
C.烃是指燃烧反应后生成二氧化碳和水的有机物
 D.烃是指仅由碳和氢两种元素组成的化合物
D.烃是指仅由碳和氢两种元素组成的化合物
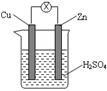
16.如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。
下列叙述正确的是
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
17.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60
mol,则此反应的平均速率
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60
mol,则此反应的平均速率![]() (X) (反应物的消耗速率或产物的生成速率)可表示为
(X) (反应物的消耗速率或产物的生成速率)可表示为
A.![]() (NH3)=0.0060 mol/(L·s) B.
(NH3)=0.0060 mol/(L·s) B.![]() (NO)=0.0040 mol/(L·s)
(NO)=0.0040 mol/(L·s)
C.![]() (O2)=0.0060 mol/(L·s) D.
(O2)=0.0060 mol/(L·s) D.![]() (H2O)=0.036 mol/(L·min)
(H2O)=0.036 mol/(L·min)
二、单项选择题 在每题的四个选项中,只有一个选项是符合要求的(本大题包括“A.化学与生活”和“B.有机化学基础”两个模块各6题,每题3分,每个模块18分。每位考生只可选择其中的一个模块作答,并填涂答题卡“填涂说明2”中对应的方框)。
A.化学与生活
18.90年代初,国际上提出了“预防污染”这一新概念.绿色化学是“预防污染”的基本手段,下列各项中属于绿色化学的是
A.处理废弃物 B.治理污染点 C.杜绝污染源 D.减少有毒物
19.某同学搜集资料发现,长期或大量摄入铝元素会对人的大脑和神经系统造成损害,为此该同学提出的下列建议中错误的是
A.少吃油条,因为油条中含有KAl(SO4)2
B.使用铁锅代替铝制炊具
C.治疗胃酸过多时尽量不服用含Al(OH)3的胃舒平
D.使用铝锅时,应加醋长时间炖煮
20.下列食物属碱性食物的是
A.面包 B.葡萄 C.鸡蛋 D.大米
21.下列关于油脂的叙述错误的是
A.油脂由C、H、O三种元素组成
B.油脂在碱性条件下不能发生水解反应
C.天然油脂的主要成份是高级脂肪酸甘油酯
D.工业上可以用油脂制造肥皂和油漆等化工产品
22.下列关于物质的使用合理的是
A.亚硝酸钠是常用的防腐剂
B.婴儿食品应添加着色剂,以增加婴儿对食物的兴趣
C.维生素C可防治坏血病,因而我们需要大量补充维生素C
D.药物可以帮助我们战胜疾病,但我们仍需合理用药
23.下列关于硅酸盐材料的说法错误的是
A.生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
B.陶瓷的主要原料是黏土
C.普通玻璃的主要成份是SiO2
D.硅酸盐水泥以石灰石和黏土原料
B.有机化学基础
18.制备一氯乙烷最好采用的方法是
A.乙烷与氯气反应 B.乙烯与氯气反应
C.乙烯与氯化氢反应 D.乙炔与氯化氢反应
19.下列物质中属于天然高分子化合物的是
A.油脂 B.麦芽糖 C.蔗糖 D.纤维素
20.居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的气体,该气体是
A.甲烷 B.氨气 C.甲醛 D.二氧化硫
21. 下列有机物分子中,所有原子均在同一平面上的是
A.环丙烷 B.苯 C.甲烷 D.甲苯
22.能在有机物分子中引入羟基的反应类型有:
①酯化;②取代;③消去;④加成;⑤水解;⑥氧化。其中正确的组合是
A.①②③⑥ B.④⑤ C.②④⑤⑥ D.②④⑥
![]() 23.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为:
23.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为:
下列关于咖啡酸的说法中,正确的是
A.属于芳香烃 B.分子式为C9H7O2
C.与过量的浓溴水发生反应生成白色沉淀 D.不能使酸性KMnO4溶液褪色
 高二化学(必修)学业水平测试模拟试题答案卷
高二化学(必修)学业水平测试模拟试题答案卷
第I卷(选择题,共69分)
一、二 单项选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 |
第Ⅱ卷(非选择题,共31分)
三、本大题包括2题,共10分。每题分为A题和B题,每位考生只可选作一题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。
24.(5分)
A.2008年春节后汽车销售形势喜人,但是汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式: 。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是(用简单的语言表达) 。
(3)控制城市空气污染源的方法可以有 (多选)
A. 开发新能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具
B.化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系。试回答下列问题。
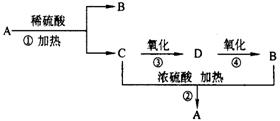 |
(1)A的名称是 (2)B的结构简式是 。
(3)D中含有的官能团(填名称)是 。
(4)在图中①~④的反应中,属于取代反应的有 。
25.(5分)
A.随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”
或“维生素”)不足引起的。
(2)微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引
起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,_________元素是合成甲
状腺激素的重要原料;人体铁元素摄入量不足可能会导致_________。
(3)人体摄入过多的食物时,会引起胃酸分泌过多,胃酸的pH下降,使人体感到不适,此时应服用消酸剂,双羟基铝酸钠就是一种常用的消酸剂,其化学式为NaAl(OH)2CO3,由于Al3+在人体内难以代谢,含量过高可导致老年痴呆症等疾病,为防止人体摄入过量铝元素,请提一条合理的建议____________________________________ 。
B.有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B式量比空气的平均式量稍小,且最简式与A相同,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的化学式。
A ;B 。
(2)A、B中 (填A、B的结构简式)存在同分异构体。
(3)写出B与溴的四氯化碳溶液反应的化学方程式:
。
四、本大题3题,共21分。
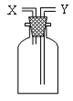 26.(5分)如右图所示的装置在实验室中用途比较广泛。
26.(5分)如右图所示的装置在实验室中用途比较广泛。
⑴若用排空气法来收集SO2气体,则进气口为 。(填“x”或“y”)
⑵若瓶中装满水,可用于收集下列气体中的 。(填编号)
①NO ②NO2 ③NH3 ④HCl
⑶若瓶中盛放浓硫酸,可用作气体干燥装置,则该装置不可以干燥的气体
有 。(填编号)
①HCl ②NH3 ③H2 ④CO
⑷若用此装置除去CO2中混有的少量SO2气体,则装置中应盛放的液体可能是 。(填编号)
①NaOH溶液 ②KMnO4溶液 ③NaHCO3溶液 ④浓H2SO4
(5)医院里给病人输氧时,往往在氧气瓶与病人呼吸面具之间安装盛有水的该装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应该从 口进入。
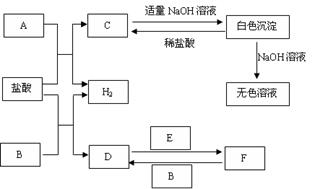 27.(5分)下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
27.(5分)下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
试回答下列问题:
(1)写出A与盐酸反应的离子方程式 。
(2)写出反应F→D的离子方程式是 。
(3)写出反应D→F的离子方程式是 。
(4)检验F中金属阳离子的常用试剂是 。
(5)工业上冶炼金属A的化学方程式是 。
28.(11分)某同学用质量分数为98%、密度为1.84 g/cm3的浓硫酸,配制100 mL 2 mol/L H2SO4溶液,并进行有关的实验。试回答下列问题:
(1)计算所需浓硫酸的体积。
(2)从下列仪器中选出实验所需要的仪器 (填序号)。
A.10 mL量筒 B.20 mL量筒 C.100 mL烧杯 D.100 mL容量瓶
E.托盘天平 F.分液漏斗 G.玻璃棒 I.胶头滴管
(3)该同学为测定某碳酸钠样品的纯度,取2.5 g该碳酸钠样品,加入足量上述稀硫酸。碳酸钠完全反应(杂质不反应),生成二氧化碳气体448mL(标准状况)。求该碳酸钠样品中Na2CO3的质量分数。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | B | B | C | C | A | D | B | A | C | C | B |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | B | A | D | D | B | C | D | B | B | D | C |
24.A.(1) 2CO+2NO=2CO2+N2 (2分)
(2) 二氧化硫被氧化为三氧化硫,进一步生成硫酸,硫酸是强酸 (1分)
(3)AB (2分)
B.(1)乙酸已酯 (2) CH3COOH
(3) 醛基 (4)①② (5)Y
25.A.(1)蛋白质 (2)钙、碘、缺铁性贫血(3)使用碳酸氢钠作为消酸剂(每空1分)
B.(1)A.C2H4 B.C4H8
(2)B C4H8
(3)CH2=CH2+ Br2 → CH2 Br CH2 Br
26.(1)y (2)① (3)② (4)②③(缺1个扣1分。有错选不得分)
27.(各1分)
(1)2Al + 6H+ == 2Al3+ + H2 ↑
(2)2Fe3+ + Fe == 3Fe2+
(3)2Fe2+ + Cl2 == 2Fe3+ + 2Cl—
|
(5)2Al2O3 ==== 4Al + 3O2↑
28.(1)10.9mL(3分)
(2)B、C、D、G、I(各1分,共5分)
(3)84.8%(3分)