高二化学竞赛联考题(三)
(时间:120分钟 满分:100分)
一、选择题(每小题只有1个正确答案,各3分,共30分)
[1].英国食品标准局于2006年3月2日在其官方网站公布消息称,一些软饮料(芬达、橙汁)可能产生致癌物。该局认为,如果汽水同时含有苯甲酸钠与维生素C这两种成分,可能产生相互作用生成苯。下列说法正确的是
A 苯甲酸钠和维生素C都是食品添加剂 B 苯甲酸钠在饮料中做为防腐剂
C 维生素C在饮料中做为抗还原剂 D 苯是一种致癌性物质
[2].很多物质的名称中含有水,“水”通常有三种含义:①表示水这种物质 ②表示水溶液 ③表示物质处于液态。下列物质名称中的“水”不是以上三种含义的是
A 重水 B 溴水 C 水银 D 水晶
[3].诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是
A 纤维素、脂肪 B 蛋白质、高级烃 C 淀粉、油脂 D 蛋白质、硬化油
[4].在实验中不慎将手指被玻璃划破,可用氯化铁溶液应急止血,其主要原因是
A FeCl3溶液具有杀菌消毒作用 B FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
C 含有的铁元素对人体有益 D FeCl3溶液能使血液聚沉
[5].最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A 分子中三个碳原子可能处于同一直线上 B 全氟冰烷的电子式为:![]()
C 全氟冰烷分子中既有极性键又有非极性键 D 相同压强下,沸点:C3F8<C3H8
 [6].如图右图所示,在-U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是
[6].如图右图所示,在-U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是
A 蓝、紫、红 B 红、蓝、紫
C 红、紫、蓝 D 紫、红、蓝
[7].下列金属或氧化物可以完全溶解的是
A 1mol Zn与含1mol HCl的稀盐酸共热
B 1mol Cu与含2mol H2SO4的浓硫酸共热
C 1mol Cu与含4mol HNO3的浓硝酸
D 1mol MnO2与含4mol HCl的浓盐酸共热
[8].设NA为阿伏加德罗常数的值,下列说法中正确的是
A 12g金刚石中所含共价键数目为NA
B 22.4L的HCl溶于水,溶液中H+数为NA
C 1 mol CO2与含1mol NaOH的溶液反应后,溶液中HCO3-数为NA
D Na2O2与H2O反应,生成常温常压下16gO2,反应中转移电子数为NA
[9].某固体A在一定温度下分解时可生存固体B,气体C和气体D:2A(s)![]() B(s)+C(g)+D(g),若测知生成的气体的质量是同温同压相同体积氢气的10倍,且当所得气体在标准状况下的体积为22.4L时,所得B的质量为30.4g,则A的摩尔质量为
B(s)+C(g)+D(g),若测知生成的气体的质量是同温同压相同体积氢气的10倍,且当所得气体在标准状况下的体积为22.4L时,所得B的质量为30.4g,则A的摩尔质量为
A 130.4g/mol B 50.4g/mol C 182.4g/mol D 252.4g/mol
[10].某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据
| 硫酸铜 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 加入的无水硫酸铜(g) | 2.5 | 4.0 | 6.0 | 8.0 |
| 析出的硫酸铜晶体(g) | 0.10 | 2.8 | 6.4 | 10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A 3.42g B 3.88g C 6.82g D 2.56g
二、选择题(每小题只有1~2个正确答案,各4分,共40分。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
[11].在雷达的微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关叙述中正确的是
A 可表示为3YO3·3FeO·Fe2O3 B 可表示为Y3O5·Fe3O4·Fe2O3
C 其中钇、铁的化合价均为+3价 D 其中钇、铁的化合价均有+2、+3价
[12].X是由两种短周期元素构成的离子晶体,1 mol X含有20 mol电子。下列说法中错误的是
A 晶体中阳离子和阴离子所含电子数一定相等 B 晶体中一定只有离子键没有共价键
C 所含元素一定不在同一周期也不在第一周期 D 晶体中阳离子半径一定小于阴离子半径
[13].将0.2mol·L-1的HX溶液和0.1mol·L-1的NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),下列关系式中一定正确的是
A c(HX)<c(X-) B c(Na+)>c(X-)
C c(H+)+c(Na+)=c(OH-)+c(X-) D c(HX)+c(X-)=0.1mol·L-1
[14].下列除去杂质的方法正确的是
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | I2 | / | 加热 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
[15].下列离子方程式书写正确的是
A 等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Fe2++2Cl-![]() Fe+Cl2↑
Fe+Cl2↑
B 稀硝酸中加入过量的铁粉:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
C 氯酸钾与浓盐酸制取少量氯气:6H++ClO3-+5Cl-=3Cl2↑+3H2O
D 盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
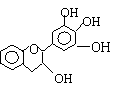 [16].“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是
[16].“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是
A 分子中所有的原子共面
B 1mol EGC与4mol NaOH恰好完全反应
C 易发生氧化反应和取代反应,难发生加成反应
D 易发生水解和显色反应,一定条件下发生消去反应
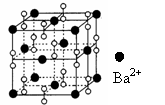 [17].钡在氧气中燃烧时的得到一种钡的氧化物晶体,其晶胞结构如右图所示,有关说法错误的是
[17].钡在氧气中燃烧时的得到一种钡的氧化物晶体,其晶胞结构如右图所示,有关说法错误的是
A 该晶体属于离子晶体
B 过氧化钠也可能具有右图所示的晶胞
C 该晶胞一定为立方晶胞(即右图为正方体)
D 与每个Ba2+(最)邻近的Ba2+共有12个
[18].根据下表下列叙述中正确的是:
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
A 表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B 氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C 还原性比较:H2O2>Mn2+>Cl-
D ④的离子方程式配平后,H+的化学计量数为16
高二化学竞赛联考题(三)
(时间:120分钟 满分:150分)
班级: 姓名:
| H 1.008 | 相对原子质量 | He 4.003 | |||||||||||||||
| Li 6.941 | Be 9.012 | B 10.81 | C 12.01 | N 14.01 | O 16.00 | F 19.00 | Ne 20.18 | ||||||||||
| Na 22.99 | Mg 24.31 | Al 26.98 | Si 28.09 | P 30.97 | S 32.07 | Cl 35.45 | Ar 39.95 | ||||||||||
| K 39.10 | Ca 40.08 | Sc 44.96 | Ti 47.88 | V 50.94 | Cr 52.00 | Mn 54.94 | Fe 55.85 | Co 58.93 | Ni 58.69 | Cu 63.55 | Zn 65.39 | Ga 69.72 | Ge 72.61 | As 74.92 | Se 78.96 | Br 79.90 | Kr 83.80 |
| Rb 85.47 | Sr 87.62 | Y 88.91 | Zr 91.22 | Nb 92.91 | Mo 95.94 | Tc [98] | Ru 101.1 | Rh 102.9 | Pd 106.4 | Ag 107.9 | Cd 112.4 | In 114.8 | Sn 118.7 | Sb 121.8 | Te 127.6 | I 126.9 | Xe 131.3 |
| Cs 132.9 | Ba 137.3 | La-Lu | Hf 178.5 | Ta 180.9 | W 183.8 | Re 186.2 | Os 190.2 | Ir 192.2 | Pt 195.1 | Au 197.0 | Hg 200.6 | Tl 204.4 | Pb 207.2 | Bi 209.0 | Po [210] | At [210] | Rn [222] |
| Fr [223] | Ra [226] | Ac-La | Rf | Db | Sg | Bh | Hs | Mt | Ds | ||||||||
一、二、选择题(共70分)
| 一 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
[19].原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,错误的是
A X原子的价电子数和核电荷数肯定为奇数
 B X能形成的酸都具有强氧化性
B X能形成的酸都具有强氧化性
C X一定能形成化学式为KXO3的含氧酸钾盐
D X与短周期金属元素形成的化合物都是离子晶体
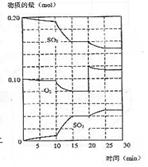
[20].600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0。反应过程中SO2、O2、SO3物质的量变化如图,下列说法错误的是
2SO3(g);△H<0。反应过程中SO2、O2、SO3物质的量变化如图,下列说法错误的是
A 反应从0 min开始,到第一次平衡时,二氧化硫的转化率为40%
B 反应进行到10min至15min的曲线变化可能升高了温度
C 反应进行至20min时,曲线发生变化是因为通入了氧气
D 在15-20min、25-30min内时反应处于平衡状态
三、(本题包括2个小题,共17分)
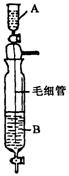 [21].(5分)在Inorganic
Syntheses一书中,有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度
[21].(5分)在Inorganic
Syntheses一书中,有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度
| 溶液名称 | 浓盐酸 | 浓硫酸 | 浓氨水 | 浓氢氧化钠溶液 | 浓醋酸 |
| 密度(g/mL) | 1.19 | 1.84 | 0.89 | 1.41 | 1.06 |
现从上述液体中选出几种适宜的试剂来利用该装置制出干燥纯净气体.
(1)制备出的气体其化学式是 。(写出全部可以制备的气体)
(2)应选用的试剂:A中盛 ;B中盛 。(任写一组)
(3)装置中毛细管的作用是 。
[22].(12分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。SCl2与SO3作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
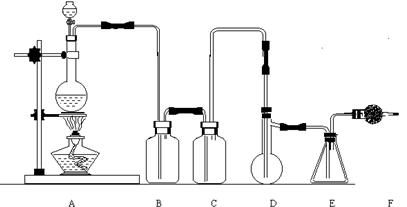
(1)装置A中发生反应的化学方程式为 。
(2)装置B盛放的药品是 ;C中是 。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50~59℃,最好采用何种方式 加热。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6)二氯化硫电子式为 ;由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
(7)亚硫酰极易水解,也能与乙醇等有机试剂反应,写出上述反应方程式
。
四、(本题包括2个小题,共20分)
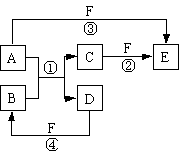 [23].(10分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
[23].(10分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是
。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是 ,反应③的化学方程式是 。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有颜色气体生成,B的结构式是 ,反应④的化学方程式是 。
[24].(10分)氧化镍是一种很有前途的材料,它被广泛应用在催化剂、电极等方面。最新液相合成路线如下:将硝酸镍(Ni(NO3)2·6H2O)和草酸(H2C2O4)分别溶于乙醇中配制成溶液,在不断搅拌硝酸镍溶液的过程中将草酸溶液逐渐转移到上述溶液中,最终生成浅蓝色沉淀,然后将沉淀过滤,在室温下干燥得到浅蓝色前驱体A,将A在700℃煅烧得到黑色的纳米氧化镍粉体(失重59.1%)。
(1)写出A的化学式 ;
(2)写出合成A和A分解为氧化镍的化学方程式;
(3)本实验以乙醇为溶剂比与水为溶剂制备有什么优点?
(4)比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。
①写出比表面积S和粒子直径D(nm)、密度ρ(g/cm3)的关系式: ;
②已知氧化镍的密度为6.67g/cm3;该纳米粒子的直径为8.0nm,计算其比表面积: 。
五、(本题包括2个小题,共23分)
[25].(7分)一种用于治疗高血脂的新药灭脂灵可按如下路线合成:
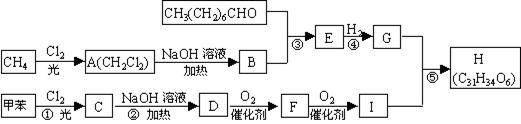
已知: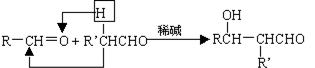
(1)写出B、E的结构简式:B ,E 。
(2)反应①~⑤中属于取代反应的有 。
(3)反应②方程式为 。
(4)反应⑤方程式为 。
[26].(16分)2005年8月8日晚,广州天河区一辆载十几吨高毒化学品的货柜车发生交通事故,导致巯基乙酸发生泄漏。巯基乙酸(A,HSCH2COOH)是无色液体,伴有特异臭味,可与水和醇、醚、苯等有机溶剂以任何比例混合;A易被空气氧化为B,经检测B分子中存在S-S键。巯基乙酸是种重要的且应用广泛的精细化工产品,一般以氯乙酸钠为原料,可由多种方法合成。
(1)写出B的结构简式 ;
(2)用硫氢化钾同氯乙酸钠反应合成巯基乙酸(钠),写出合成反应方程式;该合成中可能产生哪2种副产物?
(3)硫脲法是是生产巯基乙酸的主要方法,其合成方法如下:用物料比氯乙酸钠∶硫脲(SC(NH2)2)=1∶1,加热搅拌反应30min后得E;用氢氧化钡在95℃水解120min,得到A的钡盐、尿素和氯化钠;再经酸化即得A。经检测E分子中不存在C=S键。写出前2步反应方程式。
(4)用氯乙酸钠和硫代硫酸钠为原料,两步法(成盐、水解)合成了巯基乙酸钠。写出反应方程式。
(5)碘量法可测定巯基乙酸的含量,写出实验原理。
六、(本题包括2个小题,共20分)
[27].(9分)铝是国民经济发展的重要材料,铝在地壳中含量约占8%,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。试完成(1)、(2)两小题
(1)实验室中用金属铝制备少量氢氧化铝,有以下3种方案
方案1:Al→Al3+→Al(OH)3
方案2:Al→AlO2-→Al(OH)3
| 方案3: | Al→Al2(SO4)3 |
|
| Al→NaAlO2 |
制备相同物质的量的氢氧化铝消耗酸和碱最少的方案是 ;按最优方案,每制备1molAl(OH)3,至少消耗3mol/LH2SO4溶液 mL,6mol/LNaOH溶液 mL。
(2)工业上制取铝的流程图如下:
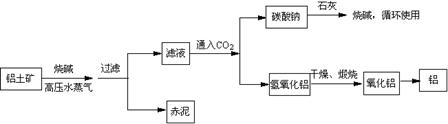
在制取氧化铝中,分析铝土矿和赤泥所得数据如下:
| Al2O3 | Fe2O3 | NaOH | 其它杂质 | |
| 铝土矿 | 55% | 16% | 0 | / |
| 赤泥 | 15% | 48% | 8% | / |
设杂质不参加反应,则每生产a吨纯净氧化铝,需铝土矿多少吨?投入的烧碱固体多少吨?
[28].有一瓶由K2FeO4和K2Cr2O7组成的混合溶液,通过下面的实验确定其浓度。取混合溶液20.00mL于锥形瓶中,加入14.00g (NH4)2Fe(SO4)2·6H2O晶体和适量硫酸,充分反应后,滴加0.0240mol/L的KMnO4溶液,至溶液显紫色时消耗23.38mL。另取混合溶液10.00mL于锥形瓶中,加等体积水稀释,加入过量KI固体,以淀粉溶液为指示剂,滴加0.8000mol/L的Na2S2O3溶液(I2+2Na2S2O3=Na2S4O6+2NaI),终点时消耗24.06mL。计算原溶液中K2FeO4和K2Cr2O7的浓度(已知上述2个K2Cr2O7参与的反应中还原产物都是Cr3+)。
参考答案(0653)
[1] C
[2] D
[3] B
[4] D
[5] C
[6] C
[7] C
[8] D
[9] B
[10] B
[11] C
[12] A
[13] C、D
[14] A
[15] C、D
[16] C
[17] B、C
[18] D
[19] B、D
[20] A、B
[21] (1)HCl(2分) (2)浓盐酸;浓硫酸(各1分) (3)减缓流速(1分)
[22] (1)MnO2+4HCl(浓)![]() MnO2+Cl2↑+2H2O(1分)
MnO2+Cl2↑+2H2O(1分)
(2)饱和食盐水(或水) 浓硫酸(各1分)
(3)增大反应接触面(1分)
(4)水浴加热,并用温度计控制温度 将锥形瓶放入冰水中冷却(各1分)
(5)碱石灰(或固体氢氧化钠或生石灰) 防止空气中水蒸气进入并吸收残留余氯气(各1分)
(6)![]() SCl2+SO3=SOCl2+SO2(各1分)
SCl2+SO3=SOCl2+SO2(各1分)
(7)SOCl2+H2O=SO2+2HCl C2H5OH+SOCl2=C2H5Cl+SO2+HCl(各1分)
[23] (1)SiO2+2C![]() Si+2CO↑(2分)
Si+2CO↑(2分)
(2)2Fe2++Cl2=2Fe3++2Cl-(1分)
H2(g)+Cl2(g)=2HCl(g);ΔH=-184.6 kJ·mol-1(2分)
(3)︰N![]() N︰(1分) 4NH3+5O2
N︰(1分) 4NH3+5O2![]() 4NO+6H2O(1.5分)
4NO+6H2O(1.5分)
(4)O=C=O(1分) C+4HNO3![]() CO2↑+4NO2↑+4H2O(1.5分)
CO2↑+4NO2↑+4H2O(1.5分)
[24] (1)A:NiC2O4·2H2O(2分)
(2)Ni2++C2O42-+2H2O=NiC2O4·2H2O NiC2O4·2H2O
![]() NiO+CO↑+CO2↑+2H2O(各1.5分)
NiO+CO↑+CO2↑+2H2O(各1.5分)
(3)以水为溶剂粒子团聚现象明显,在乙醇中可使颗粒物更小。(1分)
(4)①DρS=6000(2分) ②S=112m2/g(2分)
[25] (1)HCHO 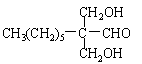 (各1分)
(各1分)
(2)①②⑤(2分)
(3)![]() (1分)
(1分)
(4)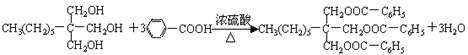 (2分)
(2分)
[26] (1)HOOCCH2SSCH2COOH(1分)
(2)ClCH2COONa+NaSH→HSCH2COONa+NaCl(1分)
NaOOCH2SCH2COONa
NaOOCH2SSCH2COONa(各1分)
(3)ClCH2COONa+H2NCSNH2→H2NC(NH)SCH2COONa+HCl(HCl可以盐的形式)
2H2NC(NH)SCH2COONa+2HCl+Ba(OH)2→2H2NCONH2+(HSCH2COO)2Ba+2NaCl(各1.5分)
(4)ClCH2COONa+Na2S2O3→NaSO3SCH2COONa+NaCl
NaSO3SCH2COONa+H2O→HSCH2COOH+NaHSO4(各1.5分)
(5)巯基乙酸与碘溶液反应(c1、V1):2HSCH2COOH+I2→(HOOCCH2S)2+2HI,以淀粉为指示剂,过量的碘用Na2S2O3(c2、V2)滴定。(3分)
[27] (1)方案3(1分);125mL(1.5分) 125 mL(1.5分)
(2)对铝土矿处理时,Fe2O3全部转移到赤泥中,从其质量含量16%→48%说明赤泥质量为原铝土矿质量的1/3,赤泥中Al2O3的含量为原铝土矿质量的5%,即利用的Al2O3占铝土矿质量的55%-5%=50%;则每生产a吨纯净氧化铝,需铝土矿2a吨(2.5分)。
根据Al2O3+2NaOH=2NaAlO2+H2O,每生产a吨纯净氧化铝需要参加化学反应的NaOH为40a/51吨,未反应的NaOH为(2a/3)×8%吨,总共需烧碱固体质量为0.84a t(2.5分)
[28] FeO42-~3Fe2+ Cr2O72-~6Fe2+ 5Fe2+~MnO4-(各0.5分)
3n(FeO42-)+6n(Cr2O72-)=n(Fe2+)-5n(MnO4-)=35.70-2.81mmol=32.89mmol(2分)
FeO42-~2I2 Cr2O72-~3I2 I2~2S2O32-(各0.5分)
4n(FeO42-)+6n(Cr2O72-)=2×0.8000×24.06mmol=38.50mmol(2分)
n(FeO42-)=5.61mmol n(Cr2O72-)=2.68mmol(各1分)
c(K2FeO4)=0.281mol/L c(K2Cr2O7)=0.134mol/L(1分)