高二化学竞赛联考题(五)
(时间:120分钟 满分:150分)
一、选择题(每小题只有1个正确答案,各3分,共30分)
[1].《科学》杂志评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A 水的电离过程是放热的过程 B 盐的水解一定能促进水的电离
C 催化剂能提高水分解的转化率 D 金属的电化腐蚀与水无关
[2].2004年2月俄罗斯杜布纳实验室的科学家宣称制得了115号元素X,经100us后放出一个α—粒子生成Z原子。下列有关X、Z的说法不正确的是
A X与Z互为同位素 B X元素是第七周期第ⅤA元素
C Z原子的核内有113个质子 D Z元素与氟元素可形成化学式为ZF3的化合物
![]() [3].如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
[3].如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
A 增大 B 减小 C 不变 D 无法确定
![]() [4].金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如图右所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是
[4].金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如图右所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是
A 4种 B 6种 C 8种 D 10种
[5].元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素形成的化合物的晶体类型为
A 分子晶体 B 原子晶体 C 离子晶体 D 金属晶体
[6].a g密度为d1 g/cm3质量分数为ω1的硝酸钾溶液,采取某种措施变成bg密度为d2g/cm3质量分数为ω2的硝酸钾饱和溶液,下列表达一定正确的是
A a>b B bω2≥aω1 C d1<d2 D a d1ω1=b d2ω2
[7].已知KMnO4溶液与KNO2溶液反应的离子方程式(未配平)如下:MnO4-+NO2-+ →Mn2++NO3-+H2O。下列说法正确的是
A MnO4-发生了氧化反应 B 氧化剂与还原剂的物质的量之比为1︰3
C 氧化产物与还原产物物质的量之比是5︰2 D 方程式空格中的物质应是OH-
[8].下列事实能用勒夏特列原理解释的是
A 氨水应密闭保存,放置低温处 B 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C 加入稀硫酸,可促进酯的水解 D 经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
[9].下列说法正确的是
A 透明陶瓷材料硒化锌是由主族元素形成的化合物
B SiO2是酸性氧化物,它不与任何酸作用
C 1mol C10H22分子中含有31mol共价键
D 元素周期表中,ⅣA族元素形成的化合物种类最多;Ⅷ族元素种类最多
[10].Fe(NO3)2加热分解反应为Fe(NO3)2-Fe2O3+NO2↑+O2↑(未配平),将Fe(NO3)2与AgNO3的混合物加热后,放出的气体通过排水法收集时得不到气体,由此可知混合物中Fe(NO3)2与AgNO3物质的量之比为
A 1︰1 B 2︰1 C 1︰2 D 无法计算
二、选择题(每小题只有1~2个正确答案,各4分,共40分。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
[11].某pH=12的溶液中加入BaCl2溶液,产生白色沉淀,再加入稀HNO3,沉淀不消失,则该溶液中存在的离子可能为
A Ag+ B SO32- C CO32- D SiO32-
[12].2004年9月3日英国《自然》杂志报道,碳化硅是已知最硬的物质之一,其单晶体可制作半导体材料。但正是由于它硬度高,熔化及锻制的过程相当费劲,而且制成的晶片容易产生瑕疵,如杂质、气泡等,这些物质会严重影响或削弱电流。因此,碳化硅一直无法被用来制造芯片。日本研究人员称,他们找到了锻制碳化硅晶体的新方法,使碳化硅晶片成本低、用途广、性能更可靠。下列有关碳化硅(SiC)的有关说法错误的是
A 晶体硅和晶体碳化硅都是原子晶体
B 碳化硅是一种新型的无机非金属材料
C 碳化硅的熔点比晶体硅高
D 制取碳化硅的反应:SiO2+3C![]() SiC+2CO↑中,SiO2是氧化剂,C是还原剂
SiC+2CO↑中,SiO2是氧化剂,C是还原剂
[13].英国媒体05年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如右:有关说法不正确的是
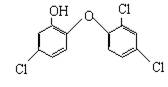 A 三氯生的分子式为:C12H6Cl3O2
A 三氯生的分子式为:C12H6Cl3O2
B 哥罗芳不存在同分异构体
C 三氯生能与氢氧化钠溶液反应
D 三氯生易溶于水
[14].已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)△H=-QkJ/mol(Q>0),则下列说法正确的是
2SO3(g)△H=-QkJ/mol(Q>0),则下列说法正确的是
A 2mol SO2(g)和1mol O2(g)所具有的内能小于2mol SO3(g)所具有的内能
B 将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小
D 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2mol SO2(g)被氧化
[15].下列有关化学实验的操作或说法中,正确的是
A 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,经干燥即可提纯甲烷
B 配制氯化铁溶液时,先将氯化铁溶于浓盐酸,再用蒸馏水稀释并加入少量铁粉
C 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低
D 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性单糖
[16].类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-地为正四面体结构
B ![]() -OH能与溴水发生取代反应;
-OH能与溴水发生取代反应;![]() -OH也可以与溴水发生取代反应
-OH也可以与溴水发生取代反应
C 钠与水反应生成NaOH和H2;铁与水反应也生成碱和H2
D H2O的沸点高于H2S;所以C2H5OH的沸点也高于C2H5SH
[17].设NA表示阿伏加德罗常数值,下列说法中正确的是
A NA个某气体分子的体积为22.4L,该气体的状况不一定是标准状况
B 1 mol苯分子中含有的碳碳双键数为3NA
C 标准状况下22.4L Cl2参加化学反应转移的电子数都是2NA
D 将46g NO2气体在降温后颜色变浅,但其所含的分子数仍然为NA
 [18].在一密闭容器中存在如下反应:2SO2+O2
[18].在一密闭容器中存在如下反应:2SO2+O2![]() 2SO3;ΔH<0。某研究小组研究了其余条件不变时,改变某一条件时对上述反应的影响,并根据实验数据做出下列关系图。下列判断中正确的是
2SO3;ΔH<0。某研究小组研究了其余条件不变时,改变某一条件时对上述反应的影响,并根据实验数据做出下列关系图。下列判断中正确的是
A 图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B 图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C 图Ⅱ研究的是温度对反应的影响,且乙的温度低
D 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
高二化学竞赛联考题(五)
(时间:120分钟 满分:150分)
班级: 姓名:
| H 1.008 | 相对原子质量 | He 4.003 | |||||||||||||||
| Li 6.941 | Be 9.012 | B 10.81 | C 12.01 | N 14.01 | O 16.00 | F 19.00 | Ne 20.18 | ||||||||||
| Na 22.99 | Mg 24.31 | Al 26.98 | Si 28.09 | P 30.97 | S 32.07 | Cl 35.45 | Ar 39.95 | ||||||||||
| K 39.10 | Ca 40.08 | Sc 44.96 | Ti 47.88 | V 50.94 | Cr 52.00 | Mn 54.94 | Fe 55.85 | Co 58.93 | Ni 58.69 | Cu 63.55 | Zn 65.39 | Ga 69.72 | Ge 72.61 | As 74.92 | Se 78.96 | Br 79.90 | Kr 83.80 |
| Rb 85.47 | Sr 87.62 | Y 88.91 | Zr 91.22 | Nb 92.91 | Mo 95.94 | Tc [98] | Ru 101.1 | Rh 102.9 | Pd 106.4 | Ag 107.9 | Cd 112.4 | In 114.8 | Sn 118.7 | Sb 121.8 | Te 127.6 | I 126.9 | Xe 131.3 |
| Cs 132.9 | Ba 137.3 | La-Lu | Hf 178.5 | Ta 180.9 | W 183.8 | Re 186.2 | Os 190.2 | Ir 192.2 | Pt 195.1 | Au 197.0 | Hg 200.6 | Tl 204.4 | Pb 207.2 | Bi 209.0 | Po [210] | At [210] | Rn [222] |
| Fr [223] | Ra [226] | Ac-La | Rf | Db | Sg | Bh | Hs | Mt | Ds | ||||||||
一、二、选择题(共70分)
| 一 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
[19].常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A 该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C 0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中c(A-)+c(HA)=c(Na+)
D 0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)
[20].铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2 240 | 4 480 | 6 720 | V |
下列计算结果正确的是
A 硝酸的浓度为4 mol/L B ①中溶解了5.6 g Fe
C ②中溶解了9.6 g Cu D ④中V=8 960
 三、(本题包括2个小题,共22分)
三、(本题包括2个小题,共22分)
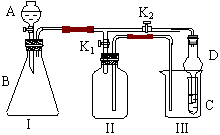
[21].(12分)某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质
(1)利用I、II装置制取气体(K2闭,K1打开)甲同学认为:利用II装置可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是
乙同学认为:利用II装置作简单改进,(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ,利用II装置再作简单改进(不改变仪器装置),还可收集NO2气体,改进方法 。
(2)利用I、III装置验证物质的性质(K2打开,K1关闭)
如设计证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
(3)请利用I、III装置自行设计有机实验,写出实验所用的试剂,简述C中的实验现象及根据此现象所得结论。
A中加 ,B中加 ,C中加 ,
现象: ,结论 。
[22].(10分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
(2)测定装置: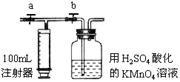 部分装置如右图所示(a、b为止水夹)
部分装置如右图所示(a、b为止水夹)
(3)实验步骤:①检查装置气密性(气密性良好)。②准确移取25.00mL 1.00×10-3mol/L的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol/L H2SO4溶液备用。③将2.00×10—3mol/L的草酸标准溶液置于酸式滴定管中备用。④打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。⑥用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。⑦再重复实验2次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00mL):
| 装修后 | 草酸溶液(mL) | 甲醛的浓度 | |||
| 1 | 2 | 3 | 平均值 | ||
| 1 | 15.86 | 15.72 | 15.67 | 15.75 | |
| 7 | 26.17 | 26.36 | 26.38 | 26.27 | |
| 30 | 30.90 | 30.67 | 30.81 | 30.79 | |
(1)写出KMnO4氧化甲醛和草酸的化学反应离子方程式。
(2)步骤④如果压送气体时速度过快,可能会产生什么不利后果?【 】
步骤⑤如果没有润洗广口瓶,对所测甲醛的含量将产生何影响?【 】
(3)计算第30天室内空气中甲醛浓度,并判断此时主人能否入住。
四、(本题包括2个小题,共20分)
[23].(10分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物;甲可由两种单质直接化合得到;乙为金属单质,在G的浓溶液中发生钝化。
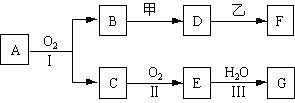
(1)若A为黄色固体,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅰ在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应Ⅰ的化学方程式是 。
(2)若A为气体;甲为淡黄色固体;F的溶液显碱性。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③若8.5g A与O2反应生成气态的B和C时放出113.35kJ热量,写出该反应的热化学方程式 。
[24].(10分)铬及其化合物是电镀、金属加工、制革等行业必不可少的原料之一,但其生产和应用也产生了大量的含铬(Ⅲ、Ⅵ)废水,严重威胁着周围的环境。通常认为三价铬毒性很小,危害最大的是六价铬的化合物,常用处理方法是将高价铬还原为低价铬。已知:①Cr(OH)3具有与Al(OH)3相似的酸碱性质;②铬(Ⅵ)在不同酸碱性条件下可以CrO42-或Cr2O72-存在。
(1)酸性条件下,NaHSO3可直接将Cr(Ⅵ)还原为Cr(Ⅲ),写出离子反应方程式;
(2)还原得到的Cr(Ⅲ)被Na2CO3碱化,再用Na2S2O8碱性条件下氧化,然后与铅盐反应可用于制备铬黄(铬酸铅和硫酸铅混合物),写出离子反应方程式;
(3)以Fe为阳极,通过电解法也可除去铬,写出反应原理和方程式。
五、(本题包括2个小题,共17分)
[25].(10分)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子),以*C表示。具有手性碳原子的有机物具有光学活性。
(1)下列分子中,没有光学活性的是 ,含有两个手性碳原子的是 。
A 乳酸:CH3—CHOH—COOH B 核糖:CH2OH—CHOH—CHOH—CHOH—CHO
C 甘油:CH2OH—CHOH—CH2OH D 脱氧核糖:CH2OH—CHOH—CHOH—CH2—CHO
(2)有机物X的结构简式为![]() ,若使X通过化学变化失去光学活性,可能发生的反应类型有
。
,若使X通过化学变化失去光学活性,可能发生的反应类型有
。
A 酯化 B 水解 C 氧化 D 还原 E 消去
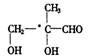
(3)有机物Y分子式为C4H8O3,它有多种同分异构体。其中属于多羟基醛,且分子中只有一个手性碳原子的异构体有数种,请写出它们的结构简式,并标出手性碳原子。
[26].(10分)有机物A是一种重要的有机化工原料,主要用于合成环氧树脂和聚碳酸树脂塑料。A的合成一般是在质子酸催化下,由苯酚和另一常见有机物B合成(副产物为1分子H2O)。A在光照下与Cl2反应(不能取代苯环上的H),得到1种1氯取代物和2种2氯取代物;A也易与溴水反应;核磁共振显示A分子中有4种不同类型的H原子,其个数比是1︰2︰2︰3。
(1)写出A、B的结构简式;
(2)写出合成A的反应方程式;
(3)1mol A能与 mol Br2的溴水反应;
(4)写出A的聚碳酸树酯的结构简式。
 六、(本题包括2个小题,共21分)
六、(本题包括2个小题,共21分)
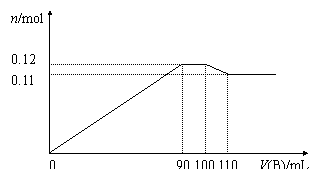
[27].(10分)向100mL BaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示:
(1)当加入110mL B溶液时,溶液中的沉淀是 (填化学式)。
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 。当B溶液加到90mL~100mL这一段时间中,所发生的离子反应方程式是 。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| c/mol·L—1 |
[28].(11分)某常见正盐X,加强热使其充分分解,未有固体残留;所得气体通入足量BaCl2溶液中,产生1.336g白色沉淀,微热溶液前后共得到89.6mL气体;如果所得气体通入足量Ba(OH)2溶液中,白色沉淀增加到1.771g,微热溶液足够时间前后共得到313.6mL气体(气体体积在标准状况下测定)。
(1)通过分析确定X的化学式;
(2)通过计算写出X的分解反应方程式。
参考答案(0655)
[1] B
[2] A
[3] C
[4] C
[5] B
[6] B
[7] C
[8] A
[9] C
[10] A
[11] B、D
[12] D
[13] A、D
[14] D
[15] C
[16] A、D
[17] A
[18] C、D
[19] A、D
[20] A、D
[21] (1)氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应(2分);将II装置加满水(1分);将II装置中加难挥发的有机溶剂(1分)。
(2)KMnO4固体(1分);NaBr溶液(1分);溶液呈橙色(1分)
(3)A:水或饱和食盐水;B:电石;C:溴水或酸性高锰酸钾溶液(各1分);溴水或酸性高锰酸钾溶液褪色(1分);乙炔为不饱和的化合物(1分)(或A:盐酸;B:大理石;C:苯酚钠溶液;变浑浊;酸性HCl>H2CO3>C6H5OH)
[22] (1)4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(各1.5分)
(2)甲醛吸收不充分,影响测定结果 结果偏高(各1.5分)
(3)27.60(3分,(75clV1—30c2V2)×103) 不能(1分)
[23] (1)①沸腾炉 吸收塔(各1分) ②点燃 光照(各0.5分) ③4FeS2+11O2![]() 2Fe2O3+8SO2(2分)
2Fe2O3+8SO2(2分)
(2)①Na+[![]() ]2-Na+(1.5分) ②2Al+2OH-+2H2O=2AlO2-+3H2↑(1.5分)
]2-Na+(1.5分) ②2Al+2OH-+2H2O=2AlO2-+3H2↑(1.5分)
③4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1(2分)
[24] (1)Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O(2分)
(2)2Cr3++3CO32-+3H2O=2Cr(OH)3+CO2↑(1分)
2Cr(OH)3+3S2O82-+10OH-=2CrO42-+6SO42-+8H2O(2分)
Pb2++CrO42-=PbCrO4↓ Pb2++SO42-=PbSO4↓(1分)
(3)电解中阳极:Fe-2e-=Fe2+(1分);阴极:2H++2e-=H2↑(1分);生成的Fe2+将Cr2O72-还原:6Fe2++Cr2O72-+14H+=6Fe3++Cr3++7H2O(1分);随着溶液pH的升高,Fe3+、Cr3+沉淀为Fe(OH)3、Cr(OH)3(1分),将其过滤加热回收。
[25] (1)C D(各1分)
(2)ABE(2分)
(3)![]()
 (各1分)
(各1分)
[26] (1)A:HO-![]()
![]()
![]() -OH(2分) CH3COCH3(2分)
-OH(2分) CH3COCH3(2分)
(2)2![]() -OH+CH3COCH3→+HO-
-OH+CH3COCH3→+HO-![]()
![]()
![]() -OH+H2O(2分)
-OH+H2O(2分)
(3)4(2分)
(4)![]() O-
O-![]()
![]()
![]() -OCO
-OCO![]() (2分)
(2分)
[27] (1)BaSO4和Fe(OH)3(2分)
(2)1∶1(2分) Ba2++SO42-=BaSO4↓ Al(OH)3+OH-=AlO2-+2H2O(各0.5分)
(3)从左到右依次为:1 1
1 0.2 0.1(各1分)
[28] (1)在碱液中难溶性气体增加,说明该气体中有NH3,即该盐是铵盐
在碱液中沉淀质量增加,说明有能溶于酸的钡盐沉淀,如果分解反应是非氧化反应,则与BaCl2反应不可能有剩余气体,因此有部分NH4+氧化为N2
酸根离子应该是高价有氧化性的,且能生成钡盐沉淀,应该是SO42-
该正盐X是(NH4)2SO4(2分,分析3分)
(2)沉淀增加的是BaSO3,质量是0.435g,即2mmol
第一次气体是4mmol,其中2mmol是SO2,另2mmol是N2
第二次气体是mmol,其中14mmol,其中N2还是2mmol,NH3是12mmol
反应物(NH4)2SO4是8mmol,由氧化还原生成SO2是6mmol,剩余SO3是2mol
4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O(2分,过程4分)