高二化学竞赛联考题(六)
(时间:120分钟 满分:150分)
一、选择题(每小题只有1个正确答案,各3分,共30分)
[1].利用新技术能将不锈钢加工成为柔软的金属丝,它和棉纤维一起编织成为防辐射的劳防服装,这是利用了金属的
A 耐腐蚀性 B 还原性 C 热传导性 D 延展性
[2].工业上冶炼金属一般用热分解法、热还原法和电解法。不同的金属应选用不同的冶炼方法。你认为选择的原则主要是依据
A 金属在自然界的存在形式 B 金属熔点的高低
C 金属离子得电子的能力 D 金属元素在地壳中的含量
[3].六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是
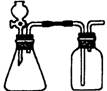 A 10 B 12 C 24 D 28
A 10 B 12 C 24 D 28
[4].利用下列各组物质制备和收集相应的气体,适宜采用右图所示装置的有下述5个制备实验中的:①电石和水;②MnO2和浓盐酸;③Cu和稀硝酸;④Na2SO3和硫酸;⑤浓盐酸和浓硫酸
A 1个 B 2个 C 3个 D 4个
[5].可逆反应3A(g)![]() 3B+C,△H>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是
3B+C,△H>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是
A B和C可能都是气体 B B和C一定都是气体
C 若C为固体,由B一定是气体 D 有可能B为固体,C为气体
[6].金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述中正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的离子只有Fe2+和Zn2+
D 电解后,Cu和Pt沉降在电解槽底部的阳极泥中
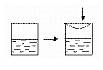 [7].在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在右图的容器中按图示操作,下列各项叙述正确的是
[7].在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在右图的容器中按图示操作,下列各项叙述正确的是
A 氨水的浓度增大,pH减小
B 液面上氨气的压强不变,水溶液的pH不变
C 液面上氨气的压强增大,溶液的浓度增大,pH变大
D 液面上氨气的压强变大,溶液的浓度增大,NH3·H2O电离程度变大
[8].下列说法不正确的有
①用稀盐酸清洗做焰色反应的铂丝;②医疗上可用碳酸钡作X射线透视肠胃的内服药;③水玻璃在建筑业上用做粘合剂;④铝和铜具有良好的导电性,所以电工操作时,可把铜线和铝线绞接在一起;⑤氯化铵可用于金属的焊接上,以除去金属表面上的氧化物薄层;⑥医用酒精的质量分数为85%;⑦用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿中是否含有葡萄糖
A 2个 B 3个 C 4个 D 5个
[9].我国纳米专家发明的“WXP复合纳米材料”的主要化学成分是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用,“WXP复合纳米材料”有望用于制造纸币。试推断以直链戊二醛(OHCCH2CH2CH2CHO)为母体的氨基二氯代戊二醛的可能结构有
A 6种 B 7种 C 8种 D 10种
[10].将7.0g纯铁条投入某200mL稀HNO3溶液中,铁条逐渐溶解,并产生大量无色气泡;一段时间后,气泡已逐渐消失,但铁条还在溶解,并最终溶解完全;同时将先前产生的无色气泡通入某装有2.4g O2和液态水的密闭容器中,振动容器后发现里面气体的压强几乎为零。则原溶液中HNO3物质的量的浓度是
A 1mol/L B 1.5mol/L C 2mol/L D 3mol/L
二、选择题(每小题只有1~2个正确答案,各4分,共40分。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
[11].向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是
A ZnSO4 B NaHCO3 C NaHSO4 D Fe(NO3)3
[12].运用元素周期律知识分析下面的推断,其中不正确的是
A 铍(Be)的氧化物的水化物可能具有两性
B 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但溶于水也溶于稀酸
C 硫酸锶(SrSO4)是难溶于水的白色固体
D 硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
[13].希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应:
4Fe3++2H2O![]() 4Fe2++4H++O2↑。下列有关该实验的说法不正确的是
4Fe2++4H++O2↑。下列有关该实验的说法不正确的是
A 反应后溶液的pH降低 B 每生成1mol O2转移4mol电子
C 叶绿体被氧化 D 该实验可说明光合作用产生的氧气来源于水
[14].为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氨水 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | NaOH | 过滤 |
[15].14C是碳的一种同位素原子。设NA为阿伏加德罗常数值,下列说法不正确的是
A 1/8mol 14CH4子所含中子数为NA
B 7g 14C原子形成的石墨中所含质子数为3NA
C 常温常压下,17g甲基(-14CH3)所含电子数为8NA
D 常温常压下,22.4L含14C的二氧化碳中分子数大于NA
[16].下列反应的离子方程式正确的是
A 过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
B 过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+CO32-
C 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
D 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O
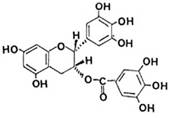 [17].美国每日科学网站4月2日文章报道:美国梅奥诊所的研究人员发现绿茶含有有助于消灭血癌细胞的成分。这项研究利用实验室培养的细胞显示,绿茶中称作“表没食子儿茶素没食子酸酯”(EGCG)的成分通过干扰血癌细胞生存所需的信号传递,能使血癌(白血病)中癌细胞自杀性死亡。另据华夏经纬网2004年2月25日报道,日本科学家发现绿茶中的EGCG能中和脂肪酸合成酵素(Fatty acid synthase简称:FAS),从而能阻止艾滋病毒扩散。已知EGCG的结构式如右图:
[17].美国每日科学网站4月2日文章报道:美国梅奥诊所的研究人员发现绿茶含有有助于消灭血癌细胞的成分。这项研究利用实验室培养的细胞显示,绿茶中称作“表没食子儿茶素没食子酸酯”(EGCG)的成分通过干扰血癌细胞生存所需的信号传递,能使血癌(白血病)中癌细胞自杀性死亡。另据华夏经纬网2004年2月25日报道,日本科学家发现绿茶中的EGCG能中和脂肪酸合成酵素(Fatty acid synthase简称:FAS),从而能阻止艾滋病毒扩散。已知EGCG的结构式如右图:
有关EGCG的说法不正确的是
A EGCG分子中含有两个手性碳原子
B EGCG遇FeCl3溶液能发生显色反应
C EGCG在空气中不易被氧化
D 1mol EGCG最多可与含10mol氢氧化钠的溶液完全作用
[18].t℃时CuSO4的溶解度是Sg,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入mg无水CuSO4或蒸发掉ng水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是
A ![]() B
B ![]() C
C ![]() D
D ![]()
高二化学竞赛联考题(六)
(时间:120分钟 满分:150分)
班级: 姓名:
| H 1.008 | 相对原子质量 | He 4.003 | |||||||||||||||
| Li 6.941 | Be 9.012 | B 10.81 | C 12.01 | N 14.01 | O 16.00 | F 19.00 | Ne 20.18 | ||||||||||
| Na 22.99 | Mg 24.31 | Al 26.98 | Si 28.09 | P 30.97 | S 32.07 | Cl 35.45 | Ar 39.95 | ||||||||||
| K 39.10 | Ca 40.08 | Sc 44.96 | Ti 47.88 | V 50.94 | Cr 52.00 | Mn 54.94 | Fe 55.85 | Co 58.93 | Ni 58.69 | Cu 63.55 | Zn 65.39 | Ga 69.72 | Ge 72.61 | As 74.92 | Se 78.96 | Br 79.90 | Kr 83.80 |
| Rb 85.47 | Sr 87.62 | Y 88.91 | Zr 91.22 | Nb 92.91 | Mo 95.94 | Tc [98] | Ru 101.1 | Rh 102.9 | Pd 106.4 | Ag 107.9 | Cd 112.4 | In 114.8 | Sn 118.7 | Sb 121.8 | Te 127.6 | I 126.9 | Xe 131.3 |
| Cs 132.9 | Ba 137.3 | La-Lu | Hf 178.5 | Ta 180.9 | W 183.8 | Re 186.2 | Os 190.2 | Ir 192.2 | Pt 195.1 | Au 197.0 | Hg 200.6 | Tl 204.4 | Pb 207.2 | Bi 209.0 | Po [210] | At [210] | Rn [222] |
| Fr [223] | Ra [226] | Ac-La | Rf | Db | Sg | Bh | Hs | Mt | Ds | ||||||||
一、二、选择题(共70分)
| 一 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
[19].乙二酸,又称草酸,通常在空气中易被氧化变质,而其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A 草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O42-
2H++C2O42-
B 已知NaHC2O4溶液显酸性,则溶液中c(C2O42-)<c(H2C2O4)
C 草酸滴定KMnO4属于中和滴定,可以不使用指示剂
D 乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
[20].在恒温、恒容条件下,反应2A(g)+B(g)![]() 2C(g)从两条途径分别建立平衡:
2C(g)从两条途径分别建立平衡:
(Ⅰ)A、B的起始浓度分别为2mol/L和1mol/L;(Ⅱ)C的起始浓度为4mol/L
以下关于平衡时的叙述正确的是
A 途径I和途径Ⅱ所得混合气体的百分组成相同
B 途径I所得C物质的浓度为途径Ⅱ所得C物质浓度的一半
C 途径I的反应速率υ(A)与途径Ⅱ的反应速率υ(C)相等
D 途径I所得混合气体的密度为途径Ⅱ所得混合气体的密度的一半
三、(本题包括2个小题,共18分)
[21].(8分)实验室现有下列药品:①蒸馏水;②用HNO3酸化的AgNO3溶液;③熟石灰;④Na2CO3;⑤NaCl;⑥食醋;⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等糊状物)。某课外兴趣小组同学准备进行下列实验研究:
(1)利用上述药品制NaOH溶液的化学方程式是 。
(2)为制备NH3,可先从废干电池中制备NH4Cl。假设将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发滤液,以制得干燥的NH4Cl晶体。你认为这一设想是否合理?答: ,其理由是 。
(3)他们在进行除去淀粉溶液中食盐的实验时,用鸡蛋壳膜自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口,这一实验的操作名称为 。要保证全部除去淀粉溶液里的食盐,实验中必须 。
(4)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重新提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的实验方案是 。
②请运用化学原理对你的方案予以解释 。
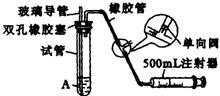 [22].(10分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如右图所示实验装置。
[22].(10分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如右图所示实验装置。
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后
(填写操作方法)时,将会看到
(填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005mol·L-1碘水1.0mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气;A溶液由
色变为 色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下左表所示。
| 浓度限值/(mg·m-3) | 分组 | 第一小组 | 第二小组 | |||
| 一级标准 | 二级标准 | 三级标准 | 抽气次数 | 100 | 120 | |
| 0.15 | 0.50 | 0.70 | SO2含量/(mg·m-3) | |||
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A。在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL)。请将上右表填写完整(计算时保留2位有效数字)。
判断该地点的空气中SO2的含量属于 (填数字)级标准, (“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题) 。
四、(本题包括2个小题,共24分)
[23].(11分)物质A由离子键和共价键构成的化合物,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质(均由短周期元素组成)之间的相互反应转化关系如下图所示:
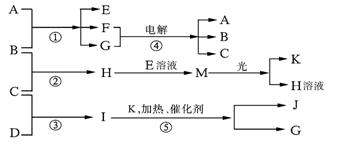
请填写下列空白:
(1)写出下列物质的化学式:B 、J 。
(2)写出A的电子式 和I的结构式 。
(3)写出下列反应的离子方程式:
H+E(溶液)→M 。
A+B→E+F+G 。
电解反应④的阴极反应 。
(4)上述工业反应①~⑤中,属于耗能产业的是 。
(5)在通常状况下,若1gC气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
[24].(13分)RX是第二周期和第三周期两种非金属元素(1︰1)化合形成的晶体。它的天然矿物称为莫瓦桑石(Moissanite),曾大量合成用作磨料,1997年,发明了它的透明单晶的合成法。用合成的莫瓦桑石透明单晶制作的首饰甚至比钻石更美丽(更显光彩、更透亮)、更轻(对比:金刚石密度3.5g/cm3,莫瓦桑石密度3.24g/cm3)、更耐火(热至1500℃不分解)、更显光彩、更透亮,价廉物美,巧夺天工,仅硬度较差,但仍是已知固体中第三种硬度最高的(对比:金刚石的硬度为10,莫瓦桑石为9.25)。RX有多种不同的晶体结构(立方、六方、密度相近),其中最常见的一种的晶胞是六方的,这种晶胞是一个平行六面体,棱长分别为a=b=3.073×10-8cm,c=15.07×10-8cm,面夹角分别为α=β=90°,γ=120°。
(1)通过计算,确定RX的摩尔质量,并写出莫瓦桑石的化学式。
(2)莫瓦桑石的上述晶胞里有几个原子?
(3)莫瓦桑石是原子晶体、分子晶体、离子晶体还是金属晶体?
(4)如何理解莫瓦桑石的密度比金刚石小?
(5)根据上述数据估算瓦桑石中R、X的半径比(不足的条件可自行合理假设)
五、(本题包括2个小题,共23分)
[25].(12分)国家质检总局4月5日宣布,在对全国18个省、市、区可能含有苏丹红的食品展开专项检查后发现,30家生产企业的88种食品及添加剂含有苏丹红。“苏丹红”属于偶氮系列化工合成染色剂,主要应用于蜡、油彩、汽油等产品。有研究表明,苏丹红可能使老鼠、兔子患癌症,也可能造成人体肝脏细胞的DNA突变,我国及许多国家都禁止将其用于食品生产。已知苏丹红家族系列的结构简式如下:
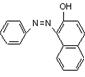
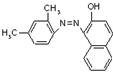
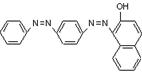
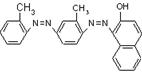
苏丹红Ⅰ 苏丹红Ⅱ 苏丹红Ⅲ 苏丹红Ⅳ
(1)请选择下列正确的说法 ;
A 苏丹红系列均呈现红色 B 苏丹红均难溶于水,易溶于油脂
C 苏丹红Ⅰ和苏丹红Ⅱ互为同系物 D 苏丹红Ⅲ和苏丹红Ⅳ互为同分异构体
E 苏丹红易发生氧化反应 F 苏丹红能与溴发生取代反应,也能与H2发生加成反应
G 苏丹红Ⅰ所有原子可能在同一平面上 H 苏丹红与亚硝酸钠、苯甲酸钠、靛蓝都不能作为食品添加剂
(2)苏丹红Ⅰ的合成方案如下:
![]()
![]() B
B![]() C
C![]() D(C6H5N2Cl)
D(C6H5N2Cl)![]() 苏丹红Ⅰ
苏丹红Ⅰ
①写出合成中A的化学式和D、E的结构简式:A 、D 、E
②苯→B、B→C、D→苏丹红1号的反应类型: ; ; 。
③写出C在水溶液中体现酸碱性的反应式 ;
④碱性条件下D可将甲醛氧化,完成反应方程式(反应产物中只要1种气体)。
⑤分子结构与苏丹红1号相似,分子式也相同,仅为羟基在环上取代位置不同,该分子同分异构体有 种(不包括苏丹红1号)。
[26].(11分)某芳香烃X,室温下为固体,取1.30g,在足量纯氧中燃烧,所得气体通入足量澄清石灰水溶液中,得到沉淀10.00g。X在光照下与Cl2反应,得到1种一氯取代物;X在AlCl3催化剂作用下与Cl2反应,也得到1种一氯取代物。X不能使溴水褪色,但可以使KMnO4溶液褪色,氧化产物干燥脱水后得到Y,Y是平面型分子(所以原子共平面),含O 32.9%。
请通过计算和分析,确定X、Y最合理的化学式,并画出结构。
六、(本题包括2个小题,共15分)
[27].(5分)用石灰石制取生石灰的化学反应式为:CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
实验测得在850到950℃之间Kp(压强单位atm)符合经验式:lgKp=7.282-8500/T
(其中T为热力学温度)
如果此反应是在不流动的空气中进行,则当温度为多少时石灰石能够完全分解?
[28].(10分)用18.4mol·L-1(ρ=1.84g·cm-3)浓硫酸吸收潮湿气体中的水蒸气,可以达到干燥气体的目的。当浓硫酸浓度降到16 mol·L-1(ρ=1.8g·cm-3)以下时,不能再作干燥剂。现有含水蒸气6%(体积分数)的潮湿氢气224L(S.T.P),用18.4mol·L-1的浓硫酸进行干燥,干燥后经测定氢气中水蒸气的含量降为1%(体积分数)。计算(保留小数点后两位):
(1)被吸收的水蒸气的质量。
(2)至少需要18.4mol·L-1的浓硫酸的质量。
(3)若将上述吸湿后的硫酸稀释,稀释后若要硫酸与水的物质的量之比为1︰25,求需要加水的质量。
(4)取上述稀释后的硫酸137g,加入足量的铁屑,恒温60℃下溶解并过滤,所得滤液从60℃冷却到0℃,求可析出绿矾(FeSO4·7H2O)的质量(0℃、60℃下FeSO4的溶解度分别为14g和35g)
参考答案(0656)
[1] D
[2] C
[3] B
[4] B
[5] B
[6] D
[7] C
[8] B
[9] C
[10] C
[11] C、D
[12] B、D
[13] C
[14] B、C
[15] C、D
[16] A、D
[17] C、D
[18] C
[19] D
[20] D
[21] (1)Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(2分)
(2)不合理,因为NH4Cl受热分解,故蒸发灼烧不可能得到NH4Cl晶体;同时,蒸发会使溶于水中的淀粉呈糊状物(各1分)
(3)渗析(1分) 必须更换渗析用的蒸馏水,至渗析液中检不出Cl-(1分)
(4)①在浓氨水中滴加浓NaOH溶液或同时加入浓NaOH溶液和NH4Cl晶体(1分)
②氨水中存在以下平衡:NH4++OH-![]() NH3·H2O
NH3·H2O![]() NH3+H2O,当向浓氨水中滴加浓NaOH溶液时,由于c(OH-)的增加,促使上述平衡正向移动,从而放出NH3(1分)
NH3+H2O,当向浓氨水中滴加浓NaOH溶液时,由于c(OH-)的增加,促使上述平衡正向移动,从而放出NH3(1分)
[22] (1)向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出(2分)
(2)蓝 无(2分) SO2+I2+2H2O=H2SO4+2HI(1分)
(3)0.064 0.53(2分) 三级 第一(2分) 抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差。(1分)
[23] (1)B:Cl2 J:NO(各1分)
(2)Na+[![]() H]-
H]- ![]() (各1分)
(各1分)
(3)H++ClO-=HClO Cl2+2OH-=Cl-+ClO-+H2O
2H2O+2e-=H2↑+2OH-(各1分)
(4)③④⑤(2分)
(5)2HCl(g)=H2(g)+Cl2(g);△H=+184.6 kJ·mol-1(2分)
[24] (1)晶胞体积:V=a2csin120°=(3.073×10-8cm)2×15.07×10-8cm×sin120°(1分)
=123.2×10-24cm3(1分)
晶胞质量数:M(nRX)=123.2×10-24cm3×3.24g/cm3×6.02×1023/mol=240g/mol(1.5分)
RX摩尔质量应在30~54g/mol,n=5、6、7、8(1分)
讨论得只有n=6时,M(RX)=40g/mol时(1分)
存在合理的化学式:SiC(1.5分)
(2)n=6,即Si和C各6个原子(1分)
(3)原子晶体(1分)
(4)硅的原子半径较大(1分)
(注:其他答案如不稳定,易分解,不硬,摩尔质量不合等不给分)
(5)假设金刚石和瓦桑石具有相似的晶体结构,
则晶胞体积比V(SiC)︰V(CC)=(40/3.24)︰(24/3.5)=1.8︰1(1分)
即它们的键长比为1.22︰1
Si、C原子的共价半径比为1.44︰1(1.4~1.5均可)(2分)
[25] (1)B、C、E、F、G(3分,多1个或少1个扣1分)
(2)①A:浓HNO3-H2SO4 D:![]() -N=N-Cl E:
-N=N-Cl E:![]() (各1分)
(各1分)
②取代反应(硝化反应)(0.5分) 还原反应(0.5分) 取代反应(1分)
③碱性:R-NH2+H2O![]() R-NH3++OH-(1分)
R-NH3++OH-(1分)
④![]() -N2Cl+HCHO+2NaOH→
-N2Cl+HCHO+2NaOH→![]() +N2+HCOONa+NaCl+H2O(2分)
+N2+HCOONa+NaCl+H2O(2分)
⑤9(1分)
[26] 由X的燃烧计算得X的最简式为CH(1分)
Y分子中H/C应比X中更小,近似认为C/O质量比为2(1分)
即Y中C 65.8%,H 1.3 %,此时Y的最简式为C8HO3(1分)
Y是平面型分子,应为酸酐,即由苯环平面和酸酐平面组成(1分)
X、Y的化学式分别为(C8H8)m和(C8H2O3)m,X的苯环侧链都为(对称)甲基(1分)
当m=3时恰好围成苯环(最稳定),即化学式X:C24H24(1分)、Y:C24H6O9(1分)
结构简式:X: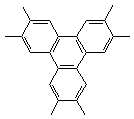 (2分) Y:
(2分) Y: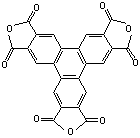 (2分)
(2分)
[27] 如果CaCO3能够在1.00atm下分解生成CO2(推动空气流动),则其就会分解完全(2分)
Kp=P(CO2)=1.00(1分) lgKp=0.00=7.282-8500/T(1分) T=1167K=894℃(1分)
[28] (1)设被吸收的水蒸气的物质的量为x mol,吸收水蒸气后混合气体的体积为(224-22.4x)L.
则224×6%-(224-22.4x)×1%=22.4x x=50/99
m(H2O)= 9.09g(2分)
(2)设至少需要18.4mol·L-1的浓硫酸xg
则18.4x/1.84=16(x+9.09)/1.8 x=72.72g(2分)
(3)n(H2SO4)=18.4×72.72×10-3/1.84=0.73 mol n(H2O)=0.73×25=18.25mol
加水:18.25×18-9.09-(72.72-0.73×98)=318.23g(2分)
(4)137g稀释后的硫酸溶液中溶质24.5g(=0.25mol)、溶剂112.5g
根据化学反应Fe+H2SO4=FeSO4+H2↑,可得FeSO4
38g,
该FeSO4溶液在60℃未达到饱和
设0℃可析出绿矾xg,则(38-152x/278)/(112.5-126x/278)=14/100 x=46g(4分)