高二化学第一学期九月份测试试题
第Ⅰ卷 (选择题 共72分)
可能用到的原子量H:1 C:12 O:16 S:32 Cl:35.5 I:127 Ba:137
一、选择题(每小题只有一个选项符合题意,每小题4分,共32分)
1、25℃时,将氯化氢气体通入纯水中,当溶液pH=2时,水电离出的[H+]约是
A.1×10-2mol·L-1 B.1×10-7mol·L-1 C.1×10-12mol·L-1 D.无法确定
2、有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处.把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0mL B.为40.0 mL C.小于40.0mL D.为10.0mL
3、下列说法一定正确的是
A、强电解质溶液的导电性比弱电解质溶液的导电性强
B、BaSO4投入水中,导电性较弱,故它是弱电解质
C、弱电解质溶液中存在两种共价化合物分子
D、氯水能导电,所以Cl2也是电解质
4、现有H+ 浓度相同的醋酸溶液和盐酸,分别用蒸溜水稀释至原体积的m倍和n倍,稀释后两溶液的H+ 浓度仍然相等,则m和n的关系是
A、m > n B、m = n C、m< n D、无法确定
5、把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5mol/L盐酸
C.0.5mol/L醋酸 D.0.5mol/L氯化钾
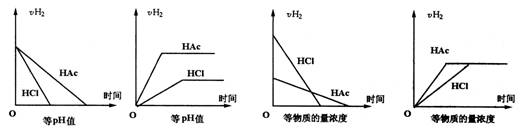 6、分别在等体积等pH或等物质的量浓度的盐酸和醋酸中加入足量镁,产生H2的体积(同温同压下测定)的变化图示如下:
6、分别在等体积等pH或等物质的量浓度的盐酸和醋酸中加入足量镁,产生H2的体积(同温同压下测定)的变化图示如下:
|
其中正确的是:
A.①③ B.② C.① D.②④
7、在一个固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2![]() N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x<y C.x=y D.不能确定
8、 将等体积的未知浓度的氢氧化钡溶液与0.10mol/L的盐酸混合,所得溶液的pH为12.0,则氢氧化钡溶液的物质的量浓度是
A.0.03 mol/L B.0.3mol/L C.0.06mol/L D.0.12mol/L
二、选择题(每小题有1~2个选项符合题意,每小题4分,共40分)
9、下列电离方程式正确的是
A、醋酸溶于水:CH3COOH =CH3COO- + H+
B、熔融状态下的NaHSO4:NaHSO4 = Na+ + H+ +SO42-
C、碳酸氢钠溶于水:HCO3-
+H2O ![]() CO32- + H3O+
CO32- + H3O+
D、硫化氢溶于水:H2S
![]() 2H+
+ S2-
2H+
+ S2-
10、在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(气)+O2(气)=2H2O(气) △H1
2H2(气)+O2(气)=2H2O(液)
△H2
B.S(气)+O2(气)=SO2(气)
△H1
S(固)+O2(气)=SO2(气)
△H2
C. C(固)+1/2O2(气)=CO(气)
△H1
C(固)+O2(气)=CO2(气)
△H2
D.H2(气)+Cl2(气)=2HCl(气)
△H1
1/2H2(气)+1/2Cl2(气)=HCl(气) △H2
11、某温度下,重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],以下关于pD的叙述正确的是
A.中性溶液中pD=7
B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),其中pD=12
C.在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中pD=2
D.向100mL 0.25mol·L-1的DCl重水溶液中加入50mL 0.2mol·L-1的NaOD的重水溶液,其中pD=2
12、在100mL 0.1mol/LCH3COOH溶液中,欲使CH3COOH电离度和溶液的pH都增大,可以采用的方法是
A.加少量1 mol/L氢氧化钠溶液 B.加少量1 mol/L盐酸
C.加100mL水 D.加热
13、在同体积pH=3的硫酸,盐酸,硝酸,醋酸溶液中,加入足量的镁粉,下列说法中正确的是
A.硫酸中放出的氢气量最多 B.醋酸中放出氢气的量最多。
C.盐酸和硝酸中放出的氢气量相等 D.盐酸比硝酸放出的氢气量多。
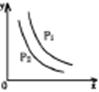 14、反应:L(s)+ aG(g)
14、反应:L(s)+ aG(g)![]() bR(g)达到平衡,温度和压强对该反应的影响如右图所示,图中:压强 P1> P2,x轴表示温度,y轴表示平衡混合气中 G 的体积分数。据此可判断
bR(g)达到平衡,温度和压强对该反应的影响如右图所示,图中:压强 P1> P2,x轴表示温度,y轴表示平衡混合气中 G 的体积分数。据此可判断
A.上述反应是放热反应 B.上述反应是吸热反应
C.a> b D.a< b
15、常温下,将pH=2的酸溶液和pH=12的苛性钠溶液等体积混合后,则溶液中
A.pH=7 B.pH≥7 C.pH≤7 D.[H+][OH-]=10-14
16、中和10mL 1.0mol/L盐酸需消耗等体积的氢氧化钠溶液或氨水。则氢氧化钠溶液和氨水的
A.pH相同 B.电离程度相同
C.物质的量浓度相同 D.溶质的质量相同。
17、下列溶液中与![]() 的NaOH溶液的pH值相同的是
的NaOH溶液的pH值相同的是
A.把pH=6的盐酸稀释1000倍。
B.把pH=10的Ba(OH)2溶液稀释10倍。
C.把10毫升![]() H2SO4溶液与10毫升
H2SO4溶液与10毫升![]() 的NaOH溶液混合
的NaOH溶液混合
D.把pH=8的NaOH溶液稀释10倍。
18、与水的电离平衡(2H2O![]() H3O++OH-)类似,在-50℃液氨也有2NH3
H3O++OH-)类似,在-50℃液氨也有2NH3![]() NH4++NH2-的电离平衡,两种离子的平衡浓度均为1×10-15mol/L,下列对于-50℃液氨离子积表述正确的是
NH4++NH2-的电离平衡,两种离子的平衡浓度均为1×10-15mol/L,下列对于-50℃液氨离子积表述正确的是
A.-50℃液氨的离子积常数为2×10-15
B.-50℃液氨的离子积常数为1×10-30
C.液氨中放入少量的NaNH2,其离子积不变
D.液氨中若放入少量NH4Cl,则[NH4+]增大,不再与[NH2-]相等,因而离子积增大
第Ⅱ卷(非选择题,共78分)
三、填空题:
19、(5分)下列物质中,属于强电解质的是 ③⑤ ;属于弱电解质的是 ⑦⑨ ;属于非电解质的是 ①⑧ 。(填序号)
①氨气 ②氯水 ③硫酸钡 ④氯气 ⑤醋酸铵 ⑥铜 ⑦水 ⑧酒精 ⑨甲酸 ⑩福尔马林
20、(3分)PH相同的①H2SO4 ②HCl ③CH3COOH ④H2CO3 按物质的量浓度由小到大排列
①②③④
21、(15分)有甲、乙、丙三个串连的电解槽,如下图所示连接。其中电极C、D、E、F都是Pt片,电解G是Fe片,H是Cu片。甲池中电解液为饱和食盐水;乙池中电解液为稀硫酸;丙池中电解液为硫酸铜。当接通电路一段时间后,现象如图所示。
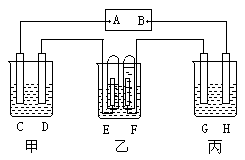 |
(1)A是 负 极,B是 正 极,C是 阴 极,D是 阳 极。
(2)若向甲池中加入少许酚酞试液, C 极附近显红色;若向甲池中加入少许淀粉碘化钾溶液, D 极附近显蓝色。
(3)G极上现象是 有红色固体析出 ,H极上的现象是 铜棒溶解变细 ,丙池是 电镀 装置。
(4)E极上发生 还原 反应,电极反应式是 2H++2e-=H2↑ ;F极上发生 氧化 反应,电极反应式是 4OH--4e-=2H2O+O2↑ 。
22、(6分)相同浓度的盐酸和醋酸溶液,它们的pH__不同_(相同或不同),其中pH大的是__醋酸__。若用相同浓度的氢氧化钠溶液分别中和pH相同,体积相同的盐酸和醋酸溶液,所消耗的氢氧化钠溶液的体积 不同(相同或不同),其中消耗氢氧化钠溶液体积多的是__醋酸_。
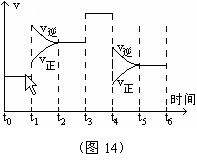
23、(6分)一密闭容器中发生下列反应N2+3H2![]() 2NH3;ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题:
2NH3;ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题:
(1)处于平衡状态的时间段是__t0~t1,t2~t3,t3~t4,t5~t6___________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了什么变化?
____升温_____、_____加催化剂____、_____减压____。
(3)下列时间段中,氨的百分含量最高的是( A )
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
 |
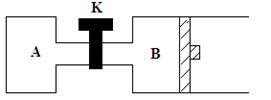 24、(4分)如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生反应2X(g)+2Y(g)
24、(4分)如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生反应2X(g)+2Y(g)![]() Z(g)+2W(g);△H<0。达到平衡(Ⅰ)时,V(B)=0.8aL。请回答:
Z(g)+2W(g);△H<0。达到平衡(Ⅰ)时,V(B)=0.8aL。请回答:
(1)B中X的转化率α(X)为 80% ;
(2)A中W和B中W的物质的量分数比较:A小于(选填“大于” “小于” “等于”)B;
(3)打开K,过一段时间重新达到平衡状态(Ⅱ)时,B的体积为 0.2aL(用a的代数式表示,连通管中气体体积不计)。
四、实验题:
25、(7分)用已知浓度的盐酸滴定未知浓度的氢氧化钾溶液(锥形瓶中加氢氧化钾溶液),滴定过程中进行如下操作,分别指出各项的操作对测定结果的影响(可用“偏高”、“偏低”、“无影响”).
(1)滴定前,滴定管尖咀处有气泡,滴定后气泡消失. 偏高 .
(2)滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定. 偏高 .
(3)滴定前,锥形瓶用蒸馏水洗涤后,未用待测的氢氧化钾溶液润洗就做滴定. 无影响 .
(4)用移液管量取待测液后,用蒸馏水洗涤移液管,并将洗涤液一起注入锥形瓶中.偏高 .
(5)滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外. 偏低 .
(6)滴定管读数时,用俯视记终点. 偏低 .
(7)滴定完毕后,在滴定管尖嘴外留有液滴. 偏高 .
26、(3分)有两种pH都等于2的溶液:一种是强酸,一种是弱酸。为了对它们作出鉴别,现在只有蒸馏水和pH试纸及各种仪器,请你设计出一可行的实验方案。答出方法和结论。
答:分别取1mL两种酸,加水稀释至100mL,用pH试纸分别测定其pH值,pH=4的为强酸, 2< pH<4的为弱酸
27、(10分)维生素C是一种水溶性维生素(是水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化. 在新鲜的水果,蔬菜,乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg·L-1左右.
校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请 填写有关空白.
(1)测定目的:测定××品牌软包橙汁维生素C含量
(2)测定原理:C6H8O6+I2 =C6H6O6+2H++2I-
(3)实验用品及试剂
① 仪器和用品:自选
② 指示剂 淀粉溶液 (填名称),浓度为7.50×10-3mol·L-1标准溶液,蒸馏水.
(4)实验过程:
① 洗涤仪器,检查滴定管是否漏液,润洗后装好标准溶液待用.
② 打开橙汁包装,用 酸式滴定管(或20mL移液管) (填仪器名称),向锥形瓶中移入20.00ml待测橙汁,滴入2滴指示剂.
③ 用左手控制滴定管的 活塞 (填部位),右手摇动锥形瓶,眼睛注视 锥形瓶中颜色的变化及液体的流速 直到滴定终点,滴定至终点的现象是 溶液由橙色变为蓝色且半分钟不变
(5)数据记录与处理.若经数据处理,滴 定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量是990 mg·L-1 .
(6)问题讨论:
① 滴定过程中能否剧烈摇动锥形瓶?为什么?
② 从分析数据看,此软包装橙汁是否是纯天然橙汁? C (填编号)
A.是 B.可能是 C.不是
制造商可能采取的做法是 C
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
五、计算题:(16分)
28、向100mL稀硫酸和稀盐酸的混合溶液中加入3.42g氢氧化钡,充分反应后,过滤、干燥得沉淀2.33g,经测定滤液pH=13.试求原混合溶液中硫酸和盐酸的物质的量浓度分别是多少? 0.1mol/L 0.1mol/L
29、将1体积SO2气体和3体积O2充入一容积固定的密闭容器中,在V2O5催化下发生反应,当达到平衡时测得容器压强为原来的90%(同一温度测定,此时SO3为气体)。(1)参加反应的氧气是多少体积? 0.4
(2)求SO2的转化率。 80%
(3)产物在反应后的混合气体中的质量分数是多少? 40%
答题纸
19、 ; ; 。
20、
21、(1) , , ,
(2) ;
(3) , ,
(4) , ; ,
22、______, ______。 , ______。
23、(1)________________________
(2)_______________、_______________、______________。
(3)
24、(1)
(2)
(3)
25、 (1) .
(2 .
(3) .
(4) .
(5) .
(6) .
(7) .
 26、
26、
27、 (1)测定目的:测定××品牌软包橙汁维生素C含量
(2)测定原理:C6H8O6+I2 =C6H6O6+2H++2I-
(3)实验用品及试剂
① 仪器和用品:自选
② 指示剂 (填名称)
(4)、① 洗涤仪器
② (填仪器名称) 向锥形瓶中移入20.00ml待测橙汁
③ 用左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视 直到滴定终点,滴定至终点的现象是
(5)维生素C的含量是 mg·L-1 .
(6)问题讨论:
① 滴定过程中能否剧烈摇动锥形瓶 ?为什么 ?
② 从分析数据看,此软包装橙汁是否是纯天然橙汁? (填编号)
制造商可能采取的做法是
28、
 |
29 、
| |